题目内容
10.氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi):(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1170.4kJ•mol-1.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是C.
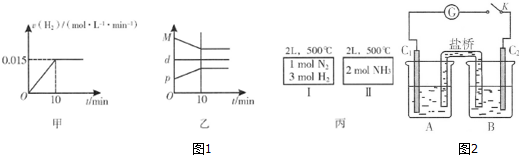
A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)?PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
②该温度下,该反应的平衡常数为0.025.
(3)①推断As元素在周期表中的位置是第四周期VA族.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+?AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是AsO42-+2H++2e-=AsO32-+H2O;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针向左偏(填“不动”、“向左偏”或“向右偏”).
分析 (1)①已知:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
Ⅱ.N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),反应热也进行相应计算;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等;
(2)①正反应为吸热反应,升高温度平衡向正反应移动;
②250s处于平衡状态,计算平衡时各组分浓度,代入平衡常数表达式K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$计算;
(3)①As处于第三周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右.
解答 解:(1)①已知:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
Ⅱ.N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),△H=
6×(-285.8kJ•mol-1)+2×180kJ•mol-1-2×(-92.2kJ•mol-1)=-1170.4kJ•mol-1,
故答案为:-1170.4kJ•mol-1;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率,而图甲中为即时速率,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化,故B错误;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等,故C正确,
故选:C;
(2)①正反应为吸热反应,升高温度平衡向正反应移动,故答案为:正向;
②250s处于平衡状态,平衡时PCl3为0.2mol,则:
PCl5(g)?PCl3(g)+Cl2(g)
起始量(mol):1 0 0
变化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.2 0.2
平衡常数K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{\frac{0.2}{2}×\frac{0.2}{2}}{\frac{0.8}{2}}$=0.025,
故答案为:0.025;
(3)①As处于第四周期VA族,故答案为:第四周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为:AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右,可观察到电流计指针向左偏,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;向左偏.
点评 本题考查化学平衡计算与影响因素、反应热计算、原电池等,(3)中注意根据平衡移动原理分析发生的反应,难度中等.

 阅读快车系列答案
阅读快车系列答案
已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)
 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.Ⅰ.(1)在容积固定且为2L的密闭容器中进行反应:
N2(g)+3H2(g)?2NH3(g),
恒温条件下,体系中某两种物质的物质的量随时间关系如图1,回答下列问题:
用H2表示15分钟内的反应速率为v(H2)=0.02mol/(L•min).
(2)实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
Ⅲ.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3,则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”),向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅳ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氨气的体积分数φ(N2)与反应温度T的关系曲线如图2所示,则上述反应的Q<0(填“>”、“<”或“=”).
 实验室制备溴苯的实验步骤如下:
实验室制备溴苯的实验步骤如下:步骤1:在a中加入苯和少量铁屑,将b中液溴慢慢加入到a中,充分反应;
步骤2:反应结束后,冷却至常温过滤反应液;
步骤3:滤液用水洗后再用10%的NaOH溶液洗,得粗溴苯;
步骤4:向粗溴苯中加入少量无水氯化钙,静置、过滤.
回答下列问题:
(1)仪器a中铁屑的作用是催化剂,a中发生的主要反应方程式是
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.(2)仪器c的作用是冷凝回流.
(3)步骤3中用水洗涤除去的物质是FeBr3,后用NaOH溶液洗涤除去的物质是Br2.
(4)步骤4得到的粗溴苯中还含有杂质苯和少量对二溴苯等,下表是有关物质的物理性质数据,为了得到纯净的溴苯,还必须要进行的实验名称是蒸馏.
| 苯 | 溴苯 | 对二溴苯 | |
| 密度/gcm-3 | 0.88 | 1.50 | 1.96 |
| 沸点/℃ | 80 | 156 | 220 |
| 水溶性 | 微溶 | 微溶 | 难溶 |
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
