题目内容
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 18g H2O在标准状况下的体积是22.4L | |
| B. | 常温常压下,4g H2含有的分子数为 2NA | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含原子数目为3NA |
分析 A、水在标况下为液体;
B、求出氢气的物质的量,然后根据分子个数N=nNA来计算;
C、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
D、求出氨气的物质的量,然后根据氨气中含4个原子来分析.
解答 解:A、水在标况下为液体,故18g水即1mol水的体积小于22.4L,故A错误;
B、4g氢气的物质的量为2mol,而分子个数N=nNA=2NA个,故B正确;
C、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠失去0.1NA个电子,故C错误;
D、17g氨气的物质的量为1mol,而氨气中含4个原子,故1mol氨气中含4NA个原子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
9.下列有机物命名正确的是( )
| A. |  2-甲基氯丙烷 2-甲基氯丙烷 | B. |  1,2,4-三甲苯 1,2,4-三甲苯 | C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
19.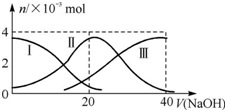 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |
3.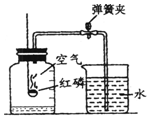 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )| A. | 该实验证明空气中氧气的质量分数约占$\frac{1}{5}$ | |
| B. | 实验时红磷要足量 | |
| C. | 实验前一定要检查装置的气密性 | |
| D. | 红磷燃烧的火焰熄灭后立刻打开弹簧夹 |
9.一次性使用的聚苯乙烯材料带来的“白色污染”是一种较为严重的污染现象.最近研制的一种新型材料能代替聚苯乙烯,它是由乳酸聚合而成的,这种材料可以在乳酸菌作用下完全降解生成CO2和H2O.下列关于聚乳酸的说法中,正确的是( )
| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸的聚合方式与聚苯乙烯相似 | |
| C. | 聚乳酸的单体为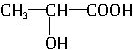 | |
| D. | 聚乳酸的降解过程不需要其他物质参与反应 |
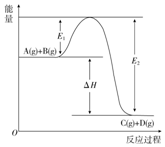 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.