题目内容
9.下列离子方程式正确的是( )| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-═CO2↑+H2O |
分析 A.氢氧化钡过量,反应生成硫酸钡、氢氧化钠和水;
B.二氧化硫少量,反应生成碳酸氢钠和亚硫酸钠;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
D.不符合反应客观事实.
解答 解:A.向NaHSO4溶液中滴加过量Ba(OH)2溶液,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故A错误;
B.用碳酸钠溶液吸收少量二氧化硫,反应生成亚硫酸钠和碳酸氢钠,反应的离子方程式为:2CO32-+SO2+H2O═2HCO3-+SO32-,故B正确;
C.少量二氧化硫通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+2HClO+Cl-,故C错误;
D.向碳酸氢钠溶液中加入氢氧化钠,离子方程式:HCO3-+OH-═CO32-+H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,为高考频考点,题目难度不大,熟悉反应的实质是解题关键,注意化学式的拆分、反应物用量对化学反应的影响,为BC易错选项.

练习册系列答案
相关题目
19.下列化学变化中属于取代反应的有( )
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在FeBr3催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在FeBr3催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
20.下列化学方程式中,不属于水解反应的是( )
| A. | CH≡CH+H2O→CH3CHO | |
| B. | C2H5Br+H2O$\frac{\underline{\;NaOH\;}}{△}$C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$\frac{\underline{\;催化剂\;}}{△}$CH3COOH+CH3OH |
17.在密闭容器中加入2.0mol SO2和1.0mol O2,一定条件下发生如下反应2SO2+O2?2SO3.反应达到平衡后,各物质的物质的量可能为( )
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关化学用语的表示正确的是( )
| A. | 氯分子的电子式: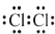 | B. | 氯离子(Cl-)的结构示意图: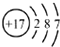 | ||
| C. | 中子数为20的氯原子: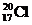 | D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
1.下列说法正确的是( )
| A. | 石油分馏的各馏分均是纯净物 | |
| B. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| D. | 溴乙烷与NaOH水溶液共热生成乙烯 |
18.按碳骨架分类,下列说法正确的是( )
| A. | 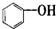 属于醇类化合物 属于醇类化合物 | B. | 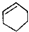 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 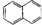 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
8. ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
(1)仪器a名称是圆底烧瓶.装置A中反应的化学方程式为2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O.用H2C2O4、稀硫酸和KClO3制备ClO2的最大优点是二氧化氯被二氧化碳稀释,可防止二氧化氯爆炸.
(2)装置C的作用是防止倒吸,装置B中用冰水浴的目的是冷凝并分离出二氧化氯.
(3)工业上生产HClO4和NaClO2的工艺流程如图所示.

①操作2的名称是蒸馏;
②设计简单实验证明HClO2为弱酸:在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸.
(4)ClO2很不稳定,需用随制,产物用水吸收得到ClO2溶液,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mLClO2溶液于锥形瓶中.
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol•L-1•的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
实验中加入的指示剂是淀粉溶液,达到滴定终点时的现象是溶液由蓝色变为无色,且保持30s不变.
原溶液中ClO2的含量为$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L(用含字母的代数式表示)g•L-1.(已知:2ClO2+8H++10I-═2Cl-+5I2+4H2,2S2O32-+I2═2I-+S2O32-)
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |
(2)装置C的作用是防止倒吸,装置B中用冰水浴的目的是冷凝并分离出二氧化氯.
(3)工业上生产HClO4和NaClO2的工艺流程如图所示.

①操作2的名称是蒸馏;
②设计简单实验证明HClO2为弱酸:在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸.
(4)ClO2很不稳定,需用随制,产物用水吸收得到ClO2溶液,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mLClO2溶液于锥形瓶中.
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol•L-1•的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
实验中加入的指示剂是淀粉溶液,达到滴定终点时的现象是溶液由蓝色变为无色,且保持30s不变.
原溶液中ClO2的含量为$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L(用含字母的代数式表示)g•L-1.(已知:2ClO2+8H++10I-═2Cl-+5I2+4H2,2S2O32-+I2═2I-+S2O32-)
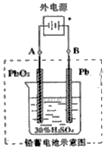 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题: