题目内容
9.现有平均相对分子量为10.25 的 CO 和 H2 组成的混合气 4.1g,与足量的O2 充分燃烧后将其迅速通入盛有足量的 Na2O2 固体的容器中,反应后固体增加的质量为4.1g.分析 CO燃烧生成二氧化碳与水,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;
氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,
由上述分析可知,固体质量的增加量就是原混合气体中CO、H2的质量和,以此来解答.
解答 解:CO燃烧生成二氧化碳与水,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;
氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,由上述分析可知,过氧化钠固体质量的增加量就是原混合气体中CO、H2的质量和,
故将4.1gH2和CO的混合气体,与足量的O2 充分燃烧后将其迅速通入盛有足量的 Na2O2 固体的容器中,反应后固体增加的质量为4.1g,
故答案为:4.1g.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应及固体增加的质量为解答的关键,侧重分析与计算能力的考查,注意气体质量与固体增重的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.有关化学用语正确的是( )
| A. | 次氯酸的电子式:H:Cl:O: | B. | Mg2+的结构示意图: | ||
| C. | 氮气的结构式: | D. | 氯化镁的电子式: |
4. 对于密闭容器中可逆反应A2(g)+3B2(g)?2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
对于密闭容器中可逆反应A2(g)+3B2(g)?2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
 对于密闭容器中可逆反应A2(g)+3B2(g)?2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
对于密闭容器中可逆反应A2(g)+3B2(g)?2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )| A. | 加入催化剂可以使状态d变为状态b | |
| B. | 若T1>T2,则逆反应一定是放热反应 | |
| C. | 达到平衡时A2的转化率大小为:b>a>c | |
| D. | 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a |
14.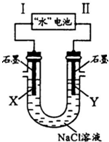 研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
 研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )| A. | I为负极,其电极反应式为Ag+Cl-+e-=AgCl | |
| B. | “水”电池内Na+不断向负极作定向移动 | |
| C. | 每转移1 mol e-,U型管中消耗0.5 mol H2O | |
| D. | “水”电池内,每生成1 mol Na2Mn5O10,X电极上生成1 mol气体 |
1.工业上常用如下方法从海水中提溴:

下列说法正确的是( )

下列说法正确的是( )
| A. | 步骤①③均发生了置换反应 | B. | 步骤③中SO2被还原 | ||
| C. | 步骤②③的目的是富集溴元素 | D. | 步骤④利用了溴易挥发的性质 |
18.膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )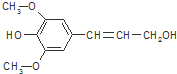

| A. | 芥子醇的分子式为C11H14O4,属于芳香族化合物 | |
| B. | 芥子醇分子中含9种不同化学环境的H原子 | |
| C. | 芥子醇分子中所有碳原子可能在同一平面上 | |
| D. | 1mol芥子醇能与足量溴水反应消耗3molBr2 |
3.下列表示对应化学反应的离子方程式或化学方程式正确的是( )
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | 碳酸钠溶液水解的离子方程式:CO32-+2H2O?H2CO3+2OH- | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 浓盐酸与MnO2共热制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |

 ;反应类型:加聚反应.
;反应类型:加聚反应.