题目内容
5.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
I.某工厂废气中含有S02,可将S02转化为(NH4)2SO4而除去.其过程为:将废气经初步处理,使其中02的体积分数为lO%(这时SO2的体积分数为0.2%),并在400℃时以5m3/h的速率通过V205触媒层,然后与流量为25L/h的NH3混合,再喷入流量为290g/h的冷水,此时气体温度迅速从400℃下降至200℃,在结晶装置中得到(NH4)2SO4晶体.据此回答下列问题:
(1)按反应中的理论值,S02和02的物质的量之比为2:1,该资料中废气中SO2与O2的物质的量之比为1:50,原因是增大02的浓度,有利于平衡向生成S03的方向移动,提高S02的转化率.
(2)进行冷却的原因是降温有利于生成(NH4)2S04,高温时(NH4)2S04会分解.
(3)有资料报道:“最近研制出一种性能优越的催化剂,可以将SO2全部催化氧化为SO3这种资料报道可信吗?不可信(填“可信”或“不可信”),其理由是S02与02的反应是可逆反应,催化剂不能使化学平衡发生移动,故不可能使S02全部转化为S03.
(4)如果将S02全部转化为S03,SO3又全部转化成(NH4)2SO4,则按题给数据计算,NH3的每小时通入量至少应是20 L,由此可得出上述过程NH3的利用率为80%.
Ⅱ.在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙.
(5)二氧化碳与石灰石浆液反应得到的产物为Ca(HC03)2或碳酸氢钙.
(6)亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:Ca(HS03)2+02=CaS04+H2S04.
分析 (1)依据平衡移动原理,增大一种反应物用量可以提高另一种反应物转化率,据此解答;
(2)依据铵盐的不稳定性,结合题意:有利于(NH4)2S04的生成;
(3)催化剂不能引起平衡移动,结合可逆反应不能进行到底的特点解答;
(4)废气中每小时排放S02为:1000 L/m3×5 m3/h×0.2%=10 L/h,氨气与S02气体的速度比值为:v(NH3):v(S02)=2:1,NH3的每小时通入量至少应是20 L,NH3的利用率为20÷25=0.8即80%;
(5)碳酸钙与二氧化碳和水反应生成碳酸氢钙;
(6)亚硫酸氢钙具有还原性,可被氧化为硫酸钙.
解答 解:(1)废气中含S02:0.2%,02:10%(体积分数),则相当于体积比2:100.即1:50,根据化学平衡移动原理,过量的02可以提高SO2的转化率,采用这样比值增大O2的浓度,提高了SO2的转化率;
故答案为:增大02的浓度,有利于平衡向生成S03的方向移动,提高S02的转化率;
(2)依据题意可知,低温有利于生成硫酸铵,且硫酸铵为铵盐,具有不稳定性,受热易分解;
故答案为:(NH4)2S04在温度高时会分解并且有利于(NH4)2S04的生成;
(3)催化剂只能改变化学反应速率,不能使化学平衡发生移动;
故答案为:不科学;S02与02的反应是可逆反应,催化剂不能使化学平衡发生移动,故不可能使S02全部转化为S03;
(4)废气中每小时排放S02为:1000 L/m3×5 m3/h×0.2%=10 L/h,氨气与S02气体的速度比值为:v(NH3):v(S02)=2:1,NH3的每小时通入量至少应是20 L,NH3的利用率为20÷25=0.8即80%;
故答案为:20; 80%;
(5)碳酸钙与二氧化碳和水反应生成碳酸氢钙;
故答案为:Ca(HC03)2或碳酸氢钙;
(6)亚硫酸氢钙具有还原性,可被氧化为硫酸钙,方程式:Ca(HS03)2+02=CaS04+H2S04;
故答案为:Ca(HS03)2+02=CaS04+H2S04.
点评 本题通过煤燃烧的脱硫过程考查了方程式书写、化学平衡影响因素、有关计算,题目难度中等,掌握二氧化硫的性质是解题关键.

| A. | 若体积减小一半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体颜色一定会变浅 | |
| C. | 若体积减小一半,压强增大,达到原来的两倍 | |
| D. | 平衡向右移动,混合气体密度增大 |
| A. | 蒸发皿 | B. | 烧杯 | C. | 锥形瓶 | D. | 蒸馏烧瓶 |
| A. | 蒸发操作时,当蒸发皿中的水分只残留少许时,停止加热,利用余热将剩余水分蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 从碘水中萃取碘时,往分液漏斗中先后加入碘水和酒精,充分静置后分液 |
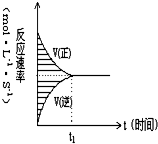 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )| A. | X的浓度的减少 | B. | Y的物质的量的减少 | ||
| C. | Y的浓度的减少 | D. | X的物质的量的减少 |
| A. | 可用澄清石灰水来区分二氧化碳和二氧化硫 | |
| B. | 可用无水硫酸铜检验酒精中是否含少量水 | |
| C. | 能使灼热的CuO由黑变红的气体一定是H2 | |
| D. | 可用石蕊试液来鉴别盐酸和醋酸 |

 和
和 .
.