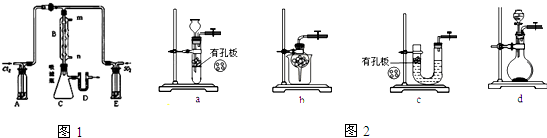
题目内容
3.根据所学知识填空:(1)已知某反应的各物质浓度数据如下:
aA(g)+bB(g)?2C(g)
起始浓度(mol•L-1):1.5 1.0 0
2s末浓度(mol•L-1):0.9 0.8 0.4
则①a=3,b=1;
②2s内用B表示该反应的反应速率为0.1mol/(L•s).
(2)由碳棒、铁片和200mL 1.5mol•L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:①有1.806×1023个电子通过了电线?(NA=6.02×1023)
②此时溶液中H+的物质的量浓度为1.5mol/L(不考虑溶液体积变化).
分析 (1)①先求出A、B的浓度变化量,浓度变化量之比等于化学计量数之比,由此确定a、b的值;
②利用v=$\frac{△c}{△t}$计算v(B);
(2)①氧化还原反应中电子转移数目即为电线中通过的电子;
②根据生成的氢气计算出参加反应的H+的物质的量,计算出溶液中H+的物质的量浓度变化量,原稀硫酸溶液中H+的物质的量浓度减去溶液中H+的物质的量浓度变化量,即为所求溶液中H+的物质的量浓度.
解答 (1)①由题目数据可知,A的浓度变化量为1.5mol/L-0.9mol/L=0.6mol/L,B的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,C的浓度变化量为0.4mol/L.
浓度变化量之比等于化学计量数之比,所以a:b:2=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,所以a=3,b=1.
故答案为:a=3;b=1;
②2s内B的反应速率v(B)=$\frac{0.2mol/L}{2s}$=0.1mol/(L•s)
故答案为:0.1mol/(L•s);
(2)①碳棒上产生气体3.36L为氢气,反应转移的电子的物质的量为$\frac{3.36L}{22.4L/mol}$×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023.
故答案为:1.806×1023;
②根据H原子守恒可知,参加反应H+的物质的量为$\frac{3.36L}{22.4L/mol}$×2=0.3mol,H+的物质的量浓度变化量△c(H+)=$\frac{0.3mol}{0.2L}$=1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L.
故答案为:1.5mol/L.
点评 考查化学平衡及反应速率计算、原电池、溶液计算等,综合较大,难度较大.

| A. | CH4与C2H4 | B. |  与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 | ||
| C. | C2H6与C3H8 | D. | C2H4与C3H6 |
| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图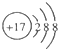 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
| A. | CaCl2 | B. | Ne | C. | Br2 | D. | Na2O |
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |

| 选项 | 反应 | 类型 | 反应条件 |
| A | ① | 取代反应 | 氢氧化钠的乙醇溶液、加热 |
| B | ② | 消去反应 | 浓硫酸、加热至170℃ |
| C | ③ | 加成反应 | 催化剂、加热 |
| D | ⑤ | 取代反应 | Cu或Ag作催化剂、加热 |
| A. | A | B. | B | C. | C | D. | D |