题目内容
19.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)═xC(g)+2D(g).经2min后测知D的浓度为0.5mol•L-1,A与B的物质的量之比为3:5,C的平均反应速率是0.125mol•L-1•min-1,求(1)x值
(2)2min后A的物质的量浓度
(3)B的转化率.
分析 利用三段式法解答,先设A、B的物质的量为nmol;C的平均反应速率是0.125mol/(L•min),生成C的物质的量=0.125mol/(L•min)×2L×2min=0.5mol;D的浓度为0.5mol/L,所以D的物质的量为:0.5mol/L×2L=1mol,
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 0.5x 1
5min(mol)(n-1.5)( n-0.5)0.5x 1
c(A):c(B)=(n-1.5)mol:(n-0.5)mol=3:5、0.5x=0.5,
解得:n=3、x=1,再根据物质的量浓度公式计算浓度;依据计算结果计算B的转化率.
解答 解:(1)设A、B初始物质的量为nmol;C的平均反应速率是0.125mol/(L•min),则生成C的物质的量=0.125mol/(L•min)×2L×2min=0.5mol;D的浓度为0.5mol/L,所以D的物质的量为:0.5mol/L×2L=1mol,
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 0.5x 1
5min(mol)(n-1.5)( n-0.5)0.5x 1
c(A):c(B)=(n-1.5)mol:(n-0.5)mol=3:5、0.5x=0.5,
解得:n=3、x=1,
答:x的值为1;
(2)2min后A的物质的量为:n-1.5mol=3mol-1.5mol=1.5mol,其物质的量浓度为:$\frac{1.5mol}{2L}$=0.75mol/L,
答:2min后A的物质的量浓度为0.75mol/L;
(3)B的转化率为:$\frac{0.5mol}{3mol}$×100%≈16.7%,
答:B的转化率为16.7%.
点评 本题考查化学平衡的计算,题目难度不大,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案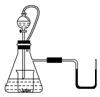 如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则下列说法正确的是( )
如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则下列说法正确的是( )| A. | U型管内液体慢慢向右移动说明将分液漏斗中的水滴入到烧杯中一定发生了化学反应 | |
| B. | U型管内液体慢慢向右移动是由于锥形瓶中气体的总物质的量增大造成压强增大而引起 | |
| C. | 该装置中连接分液漏斗和锥形瓶的橡胶管对于上述实验现象而言其实是可有可无的 | |
| D. | 小烧杯中的物质可以是NaOH也可以是Na2O |
| A. | NaH是还原剂 | B. | NaH是氧化剂 | ||
| C. | H2O是还原剂 | D. | H2O既不是氧化剂又不是还原剂 |
| A. | 只有一个“-CH3” | B. | 只有一个“ ” ” | C. | 只有一个“ ” ” | D. | 有4个“-CH2-” |
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物稳定性HX<H2Y<ZH3 | |
| B. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越弱 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 |

 .
. .
. .我们还学习了与乙醇结构相似的一系列有机物如:
.我们还学习了与乙醇结构相似的一系列有机物如: