题目内容
3.一些烷烃的燃烧热(KJ/mol)如表:下列表达正确的是( )| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 稳定性:正丁烷>异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热大约在3540 KJ/mol左右 | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
分析 A.物质具有的能量越低,越稳定;
B.乙烷的燃烧热为1560.8KJ/mol,说明完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量;
C.根据图表得出,正丁烷的燃烧热比异丁烷燃烧热高些,以此来分析正戊烷的燃烧热;
D.相同质量的烷烃,燃烧放热多少和氢的质量分数有关.
解答 解:A.由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故A错误;
B.根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3121.6kJ/mol,故B错误;
C.正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正戊烷的燃烧热大于2-甲基丁烷,即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故C正确;
D.相同质量的烷烃,氢的质量分数越大,燃烧放热越多,故D错误,
故选C.
点评 本题考查了燃烧热的概念及应用、能量与物质稳定性的关系以及学生对数据的分析处理能力等,为高频考点,侧重考查学生的分析能力,难度中等,C为易错点,注意分析互为同分异构体的燃烧热关系.

练习册系列答案
相关题目
5.氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是(注意:HCl与NH3极易反应而生成白烟)( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1molN2有6mol电子转移 | D. | 该反应属于复分解反应 |
11.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用如图装置制取高纯度的苯甲酸甲酯.
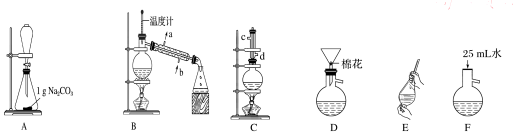
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.

| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.
18.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )


| A. | 31g白磷分子中含有P-P键个数为1.5×6.02×1023 | |
| B. | 48g O2和48g O3所含分子数相等 | |
| C. | 1mol/L氨水中,NH3•H2O的分子数为6.02×1023 | |
| D. | 20g重水(D2O)中含有的中子数为8×6.02×1023 |
8.常温下,在pH=1的某溶液中可能有Na+、Fe2+、Fe3+、I-、Cl-、CO32-中的几种,现取100mL,该溶液进行如下实验,根据实验结果,下列判断正确的是( )


| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |
15.下列有关物质用途的叙述中,不正确的是( )
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | 乙烯可以调节植物生长 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
12.为证明氨水是弱电解质,下列方法不正确的是( )
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
7.下列离子在溶液中能大量共存的是( )
| A. | OH-、K+、Cl- | B. | Ca2+、NO3-、CO32- | C. | Fe3+、Na+、OH- | D. | H+、HCO3-、SO42- |
