题目内容
用离子方程式解释下列事实:
(1)铝制餐具不宜用来蒸煮或长时间存放碱性食物: ;
(2)铁钉放入稀硝酸中溶液变黄
(3)将NaHSO4溶液滴加到滴有酚酞试液的Ba(OH)2溶液中,当溶液的颜色刚好由红色变为无色时,反应的离子方程式为 .
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式 .
(1)铝制餐具不宜用来蒸煮或长时间存放碱性食物:
(2)铁钉放入稀硝酸中溶液变黄
(3)将NaHSO4溶液滴加到滴有酚酞试液的Ba(OH)2溶液中,当溶液的颜色刚好由红色变为无色时,反应的离子方程式为
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式
考点:离子方程式的书写
专题:离子反应专题
分析:(1)氧化铝属于两性氧化物,Al、Al2O3和强碱反应生成可溶性偏铝酸盐;
(2)铁和稀硝酸反应生成硝酸铁和NO;
(3)硫酸氢钠和氢氧化钡溶液反应,当溶液的颜色刚好由红色变为无色时,说明溶液呈中性,二者反应生成硫酸钡和水、硫酸钠;
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,二者以1:1反应生成硫酸钡、二氧化碳、水和碳酸氢钠.
(2)铁和稀硝酸反应生成硝酸铁和NO;
(3)硫酸氢钠和氢氧化钡溶液反应,当溶液的颜色刚好由红色变为无色时,说明溶液呈中性,二者反应生成硫酸钡和水、硫酸钠;
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,二者以1:1反应生成硫酸钡、二氧化碳、水和碳酸氢钠.
解答:
解:(1)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+2H2O,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:Al2O3+2OH-═2AlO2-+2H2O;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(2)铁和稀硝酸反应生成硝酸铁和NO,离子方程式为Fe+4H++NO3-═4Fe3++2H2O+NO↑,故答案为:Fe+4H++NO3-═4Fe3++2H2O+NO↑;
(1)硫酸氢钠和氢氧化钡溶液反应,当溶液的颜色刚好由红色变为无色时,说明溶液呈中性,二者反应生成硫酸钡和水、硫酸钠,离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,二者以1:1反应生成硫酸钡、二氧化碳、水和碳酸氢钠,离子方程式为Ba2++SO42-+H++HCO3-═BaSO4↓+H2O+CO2↑,故答案为:Ba2++SO42-+H++HCO3-═BaSO4↓+H2O+CO2↑.
故答案为:Al2O3+2OH-═2AlO2-+2H2O;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(2)铁和稀硝酸反应生成硝酸铁和NO,离子方程式为Fe+4H++NO3-═4Fe3++2H2O+NO↑,故答案为:Fe+4H++NO3-═4Fe3++2H2O+NO↑;
(1)硫酸氢钠和氢氧化钡溶液反应,当溶液的颜色刚好由红色变为无色时,说明溶液呈中性,二者反应生成硫酸钡和水、硫酸钠,离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,二者以1:1反应生成硫酸钡、二氧化碳、水和碳酸氢钠,离子方程式为Ba2++SO42-+H++HCO3-═BaSO4↓+H2O+CO2↑,故答案为:Ba2++SO42-+H++HCO3-═BaSO4↓+H2O+CO2↑.
点评:本题考查了离子方程式的书写,明确物质的性质及发生的反应是解本题关键,注意(2)(3)(4)中反应与反应物的量有关,反应物的量不同,产物不同,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
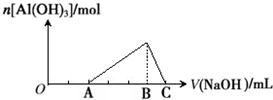

| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104 |
| D、C点溶液中的溶质只有NaAlO2 |
在某无色透明溶液中能大量共存的离子组是( )
| A、Cu2+、Na+、NO3-、Cl- |
| B、NH4+、Mg2+、NO3-、CO32- |
| C、Ag+、Na+、CO3-、Cl- |
| D、Na+、K+、NO3-、SO42- |
 为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
