题目内容
10. 某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:(1)沉淀A的化学式是SiO2,滤液B中的含铝元素的化合物化学式是NaAlO2.
(2)写出步骤②中发生的两个主要反应,用离子方程式表示为:
Fe+2H+=Fe2++H2↑,Fe+2Fe3+=3Fe2+.
(3)步骤③中发生的主要离子方程式为AlO2-+CO2+H2O═Al(OH)3↓+HCO3-.
分析 由分离提纯流程可知,氧化铝样品中含有氧化铁和二氧化硅杂质,加入过量盐酸,氧化铝与过量盐酸反应生成氯化铝,氧化铁和盐酸反应生成氯化铁,只有二氧化硅不与盐酸反应,沉淀A为SiO2,滤液A中为氯化铝、氯化铁、盐酸,则滤液A中加入过量NaOH,氯化铝与碱反应生成偏铝酸钠和氯化钠,氯化铁与碱反应生成氢氧化铁沉淀和氯化钠,盐酸与碱反应生成氯化钠,则沉淀B为Fe(OH)3,滤液B中有NaAlO2、NaCl、NaOH,所以滤液B中的阴离子除了Cl-、OH-外还有AlO2-,通二氧化碳与AlO2-反应生成氢氧化铝沉淀,最后加热生成氧化铝,以此来解答.
解答 解:(1)由上述分析可知,沉淀A为SiO2,滤液B中的阴离子除了Cl-、OH-外还有AlO2-,含铝元素的化合物化学式是NaAlO2,故答案为:SiO2;NaAlO2;
(2)滤液A中若加入过量的铁粉,②中可能发生的所有离子方程式为Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+;
(3)③的离子反应方程式为AlO2-+CO2+H2O═Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+H2O═Al(OH)3↓+HCO3-.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应及混合物的分离方法、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
9.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 在CuSO4溶液中滴加KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质的转化在给定条件下能实现的是( )
| A. | Na $\stackrel{O_{2}/△}{→}$Na2O2 $\stackrel{HI(aq)}{→}$NaI | |
| B. | Fe2O3$\stackrel{H_{2}SO_{4}(aq)}{→}$Fe2(SO4)3(aq)$\stackrel{△}{→}$无水Fe2(SO4)3 | |
| C. | H2SiO3 $\stackrel{△}{→}$SiO2 $\stackrel{HCl(aq)}{→}$SiCl4 | |
| D. | 粗铜Cu$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$Cu |
5.一种元素与另一种元素的本质区别是( )
| A. | 相对原子质量不同 | B. | 质子数不同 | ||
| C. | 中子数不同 | D. | 电子数不同 |
15. A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
 A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B>D | |
| C. | B、C、D与A形成的简单化合物的熔点:C>D>B | |
| D. | 原子半径:D>B>C>A |
2.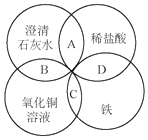 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HCl═H2O+Cl- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Fe+Cu2+═Cu+Fe2+ | D. | Fe+2H+═Fe3++2H2↑ |
19.能和溴水发生加成反应,并使溴水褪色的是( )
| A. | 苯 | B. | 甲苯 | C. | 苯乙烯 | D. | SO2 |
7.某金属氯化物MCl2 40.5g,含有0.6mol Cl-,则金属M的摩尔质量为( )
| A. | 135 g•mol-1 | B. | 99.5g•mol-1 | C. | 67.5 g•mol-1 | D. | 64 g•mol-1 |