题目内容
下列物质的电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:电子式
专题:
分析:A.Cl原子最外层有7个电子;
B.二氧化碳中存在两对碳氧共用电子对;
C.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子.
B.二氧化碳中存在两对碳氧共用电子对;
C.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子.
解答:
解:A.Cl2的电子式为: ,故A错误;
,故A错误;
B.二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故B错误;
,故B错误;
C.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故C错误;
,故C错误;
D.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢的电子式为 ,故D正确.
,故D正确.
故选D.
 ,故A错误;
,故A错误; B.二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
 ,故B错误;
,故B错误;C.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为
 ,故C错误;
,故C错误;D.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢的电子式为
 ,故D正确.
,故D正确.故选D.
点评:本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 氧化铁 Fe3O4 |
| B、酸性氧化物 碳酸气 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
有一类有机硅化合物中只含有硅元素和氢元素,叫硅烷,它们的分子组成与烷烃相似,其中有一种结构最简单的硅烷叫甲硅烷(SiH4),则有关描述不正确的是( )
| A、硅烷的分子通式可表示为SinH2n+2 |
| B、甲硅烷的稳定性比甲烷强 |
| C、甲硅烷的沸点高于甲烷 |
| D、甲硅烷燃烧生成SiO2和H2O |
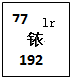 美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).
美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).以下说法正确的是( )
| A、铱原子核外有77个电子 |
| B、铱元素的原子构成了一种非金属化合物 |
| C、铱原子核中有192个中子 |
| D、铱元素的相对原子质量为77 |
将一小块钠投入下列溶液中,既能产生气体又会出现红褐色沉淀的是( )
| A、稀H2SO4 |
| B、氢氧化钠溶液 |
| C、硫酸铜溶液 |
| D、氯化铁溶液 |

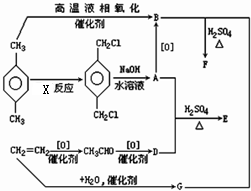 有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成:
有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成: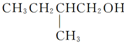 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式: