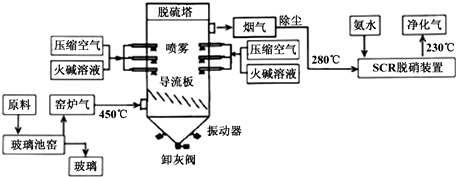
题目内容
11.分子式为C7H6O2 的芳香化合物(只有一个环),其同分异构体最多有( )种.| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C7H6O2 的芳香化合物(只有一个环),该有机物的不饱和度为:$\frac{7×2+2-6}{2}$=5,苯环的不饱和度为4,则该有机物的侧链还含有1个双键,说明该有机物为同碳原子数的一元酸和一元酯,或者为酚羟基苯甲醛,据此进行解答.
解答 解:芳香族化合物的分子式为C7H6O2,其不饱和度为:$\frac{7×2+2-6}{2}$=5,苯环的不饱和度为4,则该有机物的侧链还含有1个双键,
即:苯环的侧链可能连接酯基、羧基或1个羟基和1个醛基,
满足条件的有机物有:苯甲酸、甲酸苯酚酯、邻羟基苯甲醛、间羟基苯甲醛、对羟基醛苯甲醛,
所以满足条件的同分异构体共5种,
故选D.
点评 本题考查了同分异构体的书写方法和类别判断,题目难度不大,注意官能团的类别异构分析书写是解题关键,明确同分异构体的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
19.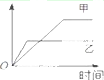 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )
 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( ) | 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3═N2+3H2 △H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3 的浓度 | 2个大气压 | 10个大气压 |
| A. | A | B. | B | C. | C | D. | D |
3.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2).用浓盐酸溶解钛铁矿去渣得溶液(含有Fe2+、TiOCl42-等),调节溶液的pH并加热,过滤得TiO2和滤液.控制反应温度在95℃左右,向滤液中加入H2O2和NH4H2PO4得到FePO4.再将FePO4与Li2CO3和H2C2O4一起煅烧,可制取LiFePO4.有关数据如下表所示:
(1)FeTiO3中Ti的化合价为+4,盐酸与FeTiO3反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.检验溶液中Fe2+的方法是先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色.
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
20.2015年国际十大环境新闻之一是“《巴黎协定》”;降低碳排放,明确全球升温控制在2℃内的目标,下列有关二氧化碳的说法不正确的是( )
| A. | 二氧化碳是一种弱电解质 | |
| B. | 金属钠着火不能用液态二氧化碳灭火 | |
| C. | 二氧化碳和水经“人工树叶”合成燃油,可实现由太阳能转变为化学能 | |
| D. | 用二氧化碳合成可降解的聚碳酸酯塑料,有利于遏制白色污染 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
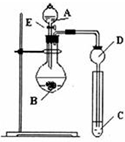 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.