题目内容
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数.回答以下问题:
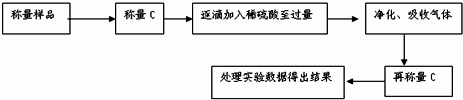
(1)化学小组主要选用了下列药品和仪器进行实验.(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b…)a→ → → → →f→g→ → .
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 .
(3)E装置的作用是 .
(4)实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”).为了确保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol?L-1的KMnO4溶液体积(V)不少于 mL.
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为 .

(1)化学小组主要选用了下列药品和仪器进行实验.(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b…)a→
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是
(3)E装置的作用是
(4)实验中,若C瓶中溶液褪色,则测定结果可能会偏
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,再根据实验原理分析,根据二氧化硫和高锰酸钾之间的关系式计算;
(5)碱石灰增重4.4g,二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,最后求出NH4HCO3的质量分数.
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,再根据实验原理分析,根据二氧化硫和高锰酸钾之间的关系式计算;
(5)碱石灰增重4.4g,二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,最后求出NH4HCO3的质量分数.
解答:
解:(1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量.
以装置连接顺序是aihdefgbc,
故答案为:i;h;d;e;b;c;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置,
故答案为:排出装置中原有空气;将生成的气体全部送入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体,防止二氧化硫对测定结果的影响,故答案为:吸收二氧化硫气体,防止二氧化硫对测定结果的影响;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,根据实验原理分析可知二氧化碳气体的质量偏大,则混合物中NH4HCO3偏大,测定结果将偏高;
高锰酸钾溶液有强氧化性,能将二氧化硫氧化生成硫酸根离子,反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,假设样品全部是亚硫酸氢钠,根据硫原子守恒得二氧化硫的物质的量=
,根据二氧化硫和高锰酸钾之间的关系式得,高锰酸钾的体积=
=
,
故答案为:高;
;
(5)碱石灰增重4.4g,即二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,NH4HCO3的质量分数为
×100%=60.3%,故答案为:60.3%.
| ||
| amol/L |
故答案为:i;h;d;e;b;c;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置,
故答案为:排出装置中原有空气;将生成的气体全部送入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体,防止二氧化硫对测定结果的影响,故答案为:吸收二氧化硫气体,防止二氧化硫对测定结果的影响;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,根据实验原理分析可知二氧化碳气体的质量偏大,则混合物中NH4HCO3偏大,测定结果将偏高;
高锰酸钾溶液有强氧化性,能将二氧化硫氧化生成硫酸根离子,反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,假设样品全部是亚硫酸氢钠,根据硫原子守恒得二氧化硫的物质的量=
| m |
| 104 |
| ||
| amol/L |
| 50m |
| 13a |
故答案为:高;
| 50m |
| 13a |
(5)碱石灰增重4.4g,即二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,NH4HCO3的质量分数为
| 7.9g |
| 13.1g |
点评:本题主要目的是测定二氧化碳气体的质量,但二氧化硫也能被碱石灰吸收,所以在吸收二氧化碳气体前应将二氧化硫气体除尽,除去二氧化硫气体一般用酸性高锰酸钾溶液或溴水,再用品红溶液检验二氧化硫气体是否除尽.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
下列关于Na2CO3和NaHCO3这两种盐描述错误的是( )
| A、可用加热的方法除去Na2CO3固体中混有NaHCO3 |
| B、可向NaHCO3溶液中通入过量的CO2气体除去其中混有的Na2CO3 |
| C、可用澄清石灰水鉴别NaHCO3和Na2CO3两种溶液 |
| D、向饱和Na2CO3溶液中通入过量的CO2气体,溶液最终有晶体析出 |
“纳米材料”是指粒子直径在几纳米到几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得的分散系的有关性质不正确的是( )
| A、不能透过滤纸 |
| B、有关丁达尔效应 |
| C、不能透过半透膜 |
| D、在外加电场的作用下可能向某一极作定向移动 |
在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后( )
| A、溶液为紫色 |
| B、汽油层呈橙色 |
| C、汽油层呈紫红色 |
| D、溶液为橙色 |