题目内容
19.下列化合物中既有离子键又有极性键的是( )| A. | MgBr2 | B. | NaOH | C. | K2O2 | D. | H2O2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,据此分析解答.
解答 解:A.溴化镁中镁离子和溴离子之间只存在离子键,为离子化合物,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B正确;
C.过氧化钾中钾离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故C错误;
D.双氧水分子中H-O原子之间存在极性键、O-O原子之间存在非极性键,故D错误;
故选B.
点评 本题考查离子键和极性键的判断,侧重考查基本概念,明确离子键、非极性键、极性键概念内涵即可解答,熟悉常见物质中存在的化学键,题目难度不大.

练习册系列答案
相关题目
9.根据元素的核电荷数,不能确定的是( )
| A. | 原子核内质子数 | B. | 原子核中子数 | ||
| C. | 原子核外的最外层电子数 | D. | 原子的电子数 |
10.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
14.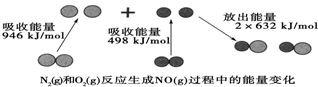 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |
4.已知12g石墨在一定条件下转化成金刚石要吸收QkJ的热量,由此可能得出的正确结论是( )
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨和金刚石比较,石墨具有的能量较高 | |
| C. | 等质量的石墨和金刚石完全燃烧,金刚石放出的能量较多 | |
| D. | 石墨转化为金刚石是物理变化 |
11.下列化合物分子中,在核磁共振氢谱图中能给出二种信号的是( )
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.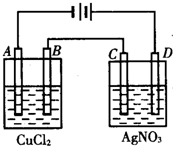 如图为以惰性电极进行电解:
如图为以惰性电极进行电解: