题目内容
铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.
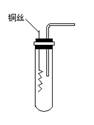
(1)某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置.请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤.
药品:稀硝酸、稀盐酸、Zn粒、CaCO3固体
步骤:①检查装置的气密性;
②______________________________
③______________________________
④______________________________
⑤______________________________
⑥用注射器向试管内推入氧气(或空气)
(2)推入氧气或空气的目的是__________________.
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异形成的,你同意这种看法吗?____________(填“同意”或“不同意”),原因是__________________;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象)____________.
解析:
| 解析:甲同学的实验步骤及原理可图示如下:
显然,甲同学是想通过沉淀Cl-来计算出混合物中NaCl的质量的.殊不知,Ag2SO4微溶于水,且AgCl烘干时易分解,这将直接导致测量结果的不准确,不可取. 乙同学的实验步骤及原理可表示如下: 即乙同学是通过沉淀混合物中SO 若要检验BaCl2过量与否,只要检验一下过滤所得滤液中是否有Ba2+即可. 答案: (1)甲选用硝酸银不合理.因为溶液中加入硝酸银溶液产生的沉淀除AgCl外还有少量微溶于水的Ag2SO4,且AgCl在加热烘干的过程中易分解,从而直接影响实验结果. (2)取少量滤液,加入Na2SO4(或稀H2SO4)溶液,若产生沉淀,则证明加入的BaCl2溶液过量.
|

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案



 铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置.请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤.药品:稀硝酸、盐酸、Zn粒、CaCO3固体
铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置.请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤.药品:稀硝酸、盐酸、Zn粒、CaCO3固体