题目内容
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
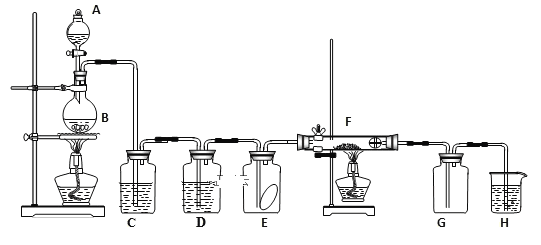
(1)写出实验室制氯气的化学方程式:___,表现还原性和酸性的盐酸物质的量之比为___。
(2)装置C中盛装的溶液是___,D中试剂的作用是___。
(3)E中的红色布条是否退色?___,F中的反应现象为____。
(4)新制氯水呈黄绿色说明其中含有____,(填化学式,下同),将AgNO3溶液滴入可观察到白色沉淀说明其中含有____。
(5)H中的试剂为___,用来吸收多余氯气。该反应的化学方程式为____。
【答案】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 1:1 饱和食盐水 干燥氯气 否 产生大量棕黄色烟 Cl2 Cl- 氢氧化钠溶液 Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+2H2O+Cl2↑ 1:1 饱和食盐水 干燥氯气 否 产生大量棕黄色烟 Cl2 Cl- 氢氧化钠溶液 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
由题干及实验装置图可知,装置A、B为制备氯气的装置,装置C中盛装的是饱和食盐水,用于除去氯气中混有的HCl,装置D中盛装的是浓硫酸,用于干燥氯气,E中放有干燥的红色布条,干燥的氯气不能使干燥的红色布条褪色,F中为红色的铜网,氯气与红色的铜反应生成棕黄色的烟,主要成分为CuCl2,H为尾气吸收装置,盛装的是氢氧化钠溶液,据此分析作答。
(1)实验室用二氧化锰和浓盐酸加热制取氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;反应中盐酸作还原剂,同时还体现酸性,二氧化锰作氧化剂,表现还原性和酸性的盐酸物质的量之比为1:1;
MnCl2+2H2O+Cl2↑;反应中盐酸作还原剂,同时还体现酸性,二氧化锰作氧化剂,表现还原性和酸性的盐酸物质的量之比为1:1;
(2)装置C用于除去氯气中混有的HCl,因此盛装的溶液是饱和的氯化钠溶液;D中盛装的是浓硫酸,用于干燥氯气;
(3)E中放置的是干燥的红色布条,干燥的氯气不能使干燥的有色布条褪色,因此E中的红色布条不褪色;F中为红色的铜网,氯气与红色的铜反应生成棕黄色的烟,主要成分为CuCl2;
(4)新制氯水呈黄绿色说明其中含有Cl2;将AgNO3溶液滴入可观察到白色沉淀说明新制的氯水中存在Cl-;
(5)装置H用于吸收多余的氯气,盛装的是氢氧化钠溶液;氢氧化钠与氯气反应,生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。

 名校课堂系列答案
名校课堂系列答案