题目内容
 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:(1)甲池中O2所在电极为
(2)N的电极反应式为
(3)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气为
(4)在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)燃料电池中氧气为正极反应物,燃料为负极反应物,与原电池的负极相连为阴极;
(2)电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(3)根据电极反应式结合电子守恒来计算;
(4)根据电极反应式结合电子守恒来计算.
(2)电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(3)根据电极反应式结合电子守恒来计算;
(4)根据电极反应式结合电子守恒来计算.
解答:
解:(1)燃料电池中氧气为正极反应物,燃料为负极反应物,与原电池的负极相连为阴极,则M与负极相连为阴极;
故答案为:正;阴;
(2)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
(3)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol?L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是1.2mol,消耗乙醇的物质的量是0.1mol,质量是0.1mol×46g/mol=4.6g,
故答案为:4.6.
故答案为:正;阴;
(2)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
(3)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol?L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是1.2mol,消耗乙醇的物质的量是0.1mol,质量是0.1mol×46g/mol=4.6g,
故答案为:4.6.
点评:本题考查了原电池原理和电解池原理的应用,注意根据串联电路中转移的电子的物质的量相等结合电极方程式计算分析,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )| A、磷化硼晶体的化学式为BP,属于离子晶体 |
| B、磷化硼晶体的熔点高,且熔融状态下能导电 |
| C、磷化硼晶体中每个原子均形成4条共价键 |
| D、磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 |
下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A、只有②⑤⑦ | B、②⑥⑦ |
| C、②④⑤⑥⑦ | D、②④⑥ |
下列物质的水溶液能够导电,但属于非电解质的是( )
| A、氯化氢气体 |
| B、CO2 |
| C、Cl2 |
| D、氯化钠 |
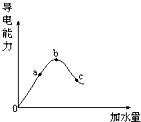 (1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答:
(1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答: