题目内容
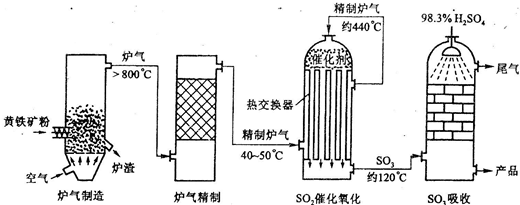
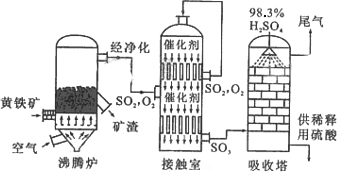
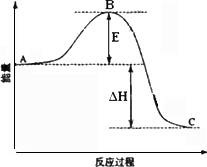
以黄铁矿为原料生产硫酸,根据下列方程式:(1)FeS2(s)+11/4O2(g)====1/2Fe2O3(s)+2SO2(g);ΔH=-835 kJ·mol-1
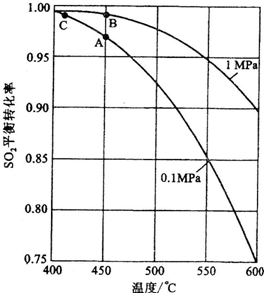
(2)SO2(g)+1/2O2(g)====SO3(g);ΔH=-98.3 kJ·mol-1
(3)SO3(g)+H2O(l)====H2SO4(l);ΔH=-130.3 kJ·mol-1
计算将1.0 mol FeS2中的硫全部转化为H2SO4,理论上可产生多少热量?
解析:FeS2 ~ 2SO2 ~ 2SO3 ~ 2H2SO4
1 mol 2 mol 2 mol 2 mol
Q=835 kJ+2×98.3 kJ+2×130.3 kJ=1310.2 kJ。
答案:1310.2 kJ

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目