题目内容
请设计一个实验验证甲酸![]() 具有“醛”酸”的双重性质,写出实验步骤。
具有“醛”酸”的双重性质,写出实验步骤。
解析:
(1)甲酸具有醛的性质: ①配制银氨溶液:向一支洁净的试管中加入2%AgNO3溶液1mL,然后用胶头滴管取2%氨水逐滴滴入,直到生成的沉淀恰好溶解为止。 ②向试管中滴入2~3滴甲酸溶液,水浴加热,观察现象。 (2)甲酸的酸性: ①用玻璃棒蘸取甲酸溶液点到pH试纸上,并用标准比色卡比较。 ②向盛有少量Na2CO3粉末的试管里加入甲酸溶液,有气泡产生,证明甲酸有酸性且比碳酸酸性强。
|

过氧化氢是一种重要的化工原料,它具有氧化性、还原性、不稳定性和弱酸性。
(1)废旧印刷电路板经粉碎处理,分离得到金属粉末和非金属粉末。控制其他条件相同,将金属粉末用10% H2O2和3.0mol?L-1 H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1 ?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是________________________________________________________________。
(2)在酸性条件下,过氧化氢可以氧化Fe2+;过氧化氢也可以被Fe3+氧化。通过改变反应途径,Fe2+和H+实际对H2O2的分解起着催化剂的作用。试用离子方程式表示Fe2+和H+对H2O2分解反应的催化过程________________________________;__________________________。
(3)下列试剂能够证明过氧化氢具有还原性的是________________(填序号)。
①酸性高锰酸钾溶液 ②KI溶液 ③亚硫酸溶液 ④Ba(OH)2溶液
(4)将H2O2溶液逐滴加入含有酚酞的NaOH溶液中,红色消失。甲同学认为是由于H2O2是弱酸性,消耗OH-,而使红色褪去;乙同学认为是由于H2O2具有强氧化性,将酚酞氧化,而使红色褪去。请设计一个实验验证甲、乙同学的解释谁正确,简述实验方案______________________________________________________________________________________________________。k.s.5.u
过氧化氢是一种重要的化工原料,它具有氧化性、还原性、不稳定性和弱酸性。
(1)废旧印刷电路板经粉碎处理,分离得到金属粉末和非金属粉末。控制其他条件相同,将金属粉末用10% H2O2和3.0mol·L-1 H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率 (×10-3mol·L-1 ·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是________________________________________________________________。
(2)在酸性条件下,过氧化氢可以氧化Fe2+;过氧化氢也可以被Fe3+氧化。通过改变反应途径,Fe2+和H+实际对H2O2的分解起着催化剂的作用。试用离子方程式表示Fe2+和H+对H2O2分解反应的催化过程________________________________;__________________________。
(3)下列试剂能够证明过氧化氢具有还原性的是________________(填序号)。
①酸性高锰酸钾溶液 ②KI溶液 ③亚硫酸溶液 ④Ba(OH)2溶液
(4)将H2O2溶液逐滴加入含有酚酞的NaOH溶液中,红色消失。甲同学认为是由于H2O2是弱酸性,消耗OH-,而使红色褪去;乙同学认为是由于H2O2具有强氧化性,将酚酞氧化,而使红色褪去。请设计一个实验验证甲、乙同学的解释谁正确,简述实验方案_______________________________________________________________________。
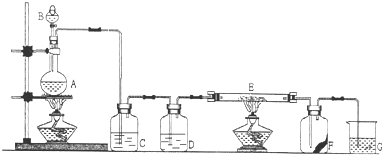
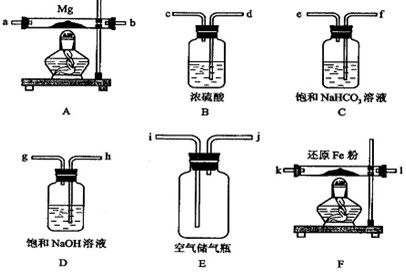
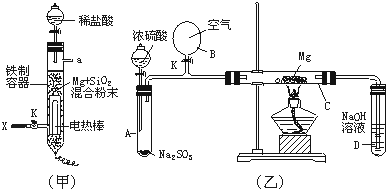
 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH-