题目内容
16.下列强碱碱性介于KOH和Mg(OH)2之间的是( )| A. | NaOH | B. | Al(OH)3 | C. | LiOH | D. | RbOH |
分析 金属的金属性越强,其最高价氧化物的水化物碱性越强,同一周期元素,元素的金属性随着原子序数增大而减弱,同一主族元素,元素的金属性随着原子序数增大而增强,据此分析解答.
解答 解:金属的金属性越强,其最高价氧化物的水化物碱性越强,同一周期元素,元素的金属性随着原子序数增大而减弱,同一主族元素,元素的金属性随着原子序数增大而增强,所以金属性Rb>K>Na>Mg>Al,所以强碱碱性介于KOH和Mg(OH)2之间的是NaOH,故选A.
点评 本题考查金属氧化物的水化物碱性强弱判断,明确金属的金属性强弱与其最高价氧化物的水化物碱性强弱关系即可解答,知道金属性强弱判断方法,题目难度不大.

练习册系列答案
相关题目
6.化学与生活息息相关,下列说法正确的是( )
| A. | 铝合金表面有致密氧化膜遇强碱不会被腐蚀 | |
| B. | 海轮外壳上装锌块可减缓腐蚀 | |
| C. | 高纯度的SiO2由于可以导电因此可用作光导纤维 | |
| D. | SO2、CO2和NO2都是可形成酸雨的气体 |
7.在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性.已知某有机物结构如下: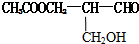 具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )
具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )
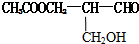 具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )
具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH溶液共热 | ||
| C. | 与氧气发生催化氧化 | D. | 在催化剂存在下与H2作用 |
4. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
①能与溴水发生取代反应
②1mol该物质最多能与4mol H2加成
③能使酸性KMnO4溶液褪色
④1mol该物质最多能与含2mol NaOH的溶液反应.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )①能与溴水发生取代反应
②1mol该物质最多能与4mol H2加成
③能使酸性KMnO4溶液褪色
④1mol该物质最多能与含2mol NaOH的溶液反应.
| A. | ①②③ | B. | ①③④ | C. | ③④ | D. | ②③④ |
11.下列有关化学用语正确的是( )
| A. | CO2的电子式  | |
| B. | Cl-的结构示意图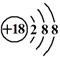 | |
| C. | 8个中子的碳原子的核素符号:${\;}_{6}^{14}$C | |
| D. | HF的电子式: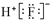 |
1.按等物质的量混合的下列气体,碳元素的质量分数最大的是( )
| A. | 甲烷和乙烷 | B. | 乙炔和丙烯 | C. | 乙烷和乙烯 | D. | 丁炔和乙烯 |
5.以下有关原子结构及元素周期律的叙述正确的是( )
| A. | 第ⅠA族元素铯的两种位素${\;}_{\;}^{137}$Cs比${\;}_{\;}^{133}$Cs多4个质子 | |
| B. | 第ⅦA族元素从上到下,其氢化物的还原性逐渐减弱 | |
| C. | 同主族元素原子半径越大,单质的熔点越高 | |
| D. | 同周期元素(除0族元素外)从左到右,简单阴离子半径逐渐减小 |
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25 NA | |
| C. | 在标准状况下,2.8g N2和2.24LCO所含质子数均为1.4NA | |
| D. | 常温下,1 L pH=1的硫酸溶液中含有的H+数为0.05NA |