题目内容
标准状况下,具有下列量的物质,其体积最大的是( )
| A、44g CO2 |
| B、11.2L H2 |
| C、2mol Fe |
| D、2mol H2O |
考点:气体摩尔体积
专题:阿伏加德罗常数和阿伏加德罗定律
分析:标准状况下,铁为固体,水为液体,二氧化碳和氢气为气体,结合n=
=
计算.
| m |
| M |
| V |
| Vm |
解答:
解:标准状况下,水为液体,铁为固体,体积较小;
二氧化碳和氢气为气体,体积较大,
其中V(CO2)=
×22.4L/mol=22.4L,V(H2)=11.2L,
则体积最大的是44gCO2,
故选A.
二氧化碳和氢气为气体,体积较大,
其中V(CO2)=
| 44g |
| 44g/mol |
则体积最大的是44gCO2,
故选A.
点评:本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用以及物质的聚集状态,难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
1,8-二硝基萘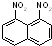 苯环上的二溴代物与四溴代物的种类分别有( )
苯环上的二溴代物与四溴代物的种类分别有( )
 苯环上的二溴代物与四溴代物的种类分别有( )
苯环上的二溴代物与四溴代物的种类分别有( )| A、9种、9种 |
| B、9种、15种 |
| C、15种、9种 |
| D、15种、15种 |
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 | ||||||||
| B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中完全反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| ||||||||
| C、氯化镁溶液与氨水反应:Mg 2++2OH -=Mg(OH)2↓ | ||||||||
D、已知强酸与强碱的稀溶液反应的中和热为57.3 KJ/mol,则0.1mol醋酸与0.1mol氢氧化钠的稀溶液反应的热化学方程式为:
|
下列离子方程式书写正确的是( )
| A、硫酸铜溶液与氢氧化钡溶液反应Ba2++SO42-═BaSO4↓ |
| B、氢氧化铝治疗胃酸 Al(OH)3+3H+═Al3++3H2O |
| C、铜与硝酸银溶液反应 Cu+Ag+═Cu2++Ag |
| D、硫酸氢钠溶液与氢氧化钠溶液反应OH-+H+═H2O |
下列反应中,最终一定有白色沉淀生成的是( )
①向Na2SO4溶液中加入稀盐酸酸化后,再加入BaCl2溶液;
②向Na2SiO3溶液中通入过量的CO2;
③向Ca(OH)2溶液中通入过量的CO2;
④向BaCl2溶液中通入少量的SO2;
⑤向Ba(NO3)2溶液中通入过量的SO2.
①向Na2SO4溶液中加入稀盐酸酸化后,再加入BaCl2溶液;
②向Na2SiO3溶液中通入过量的CO2;
③向Ca(OH)2溶液中通入过量的CO2;
④向BaCl2溶液中通入少量的SO2;
⑤向Ba(NO3)2溶液中通入过量的SO2.
| A、①② | B、①③④ |
| C、①②⑤ | D、②③④ |
一氧化氮是大气的主要污染物之一.但近几年来又发现生物体内存在的少量一氧化氮有扩张血管、增强记忆力的功能,成为当前生命科学研究的热点.工业上制取一氧化氮的化学方程式为:4X+5O2
4NO+6H2O,则X的化学式为( )
| ||
| A、N2 |
| B、NO2 |
| C、NH3 |
| D、N2O5 |
下列有机物的命名正确的是( )
A、 2-乙基丙烷 2-乙基丙烷 |
| B、CH3-CH=CH-CH3 2-丁烯 |
C、 3,4─二甲基戊烷 3,4─二甲基戊烷 |
D、 二甲基苯 二甲基苯 |
对于达到平衡的可逆反应H2(g)+I2(g)?2HI(g) (正反应是放热反应),欲使混合气体的颜色变深,应采取的措施是( )
| A、升高温度 | B、降低温度 |
| C、增大压强 | D、减少压强 |
在强碱性溶液中,下列离子组能大量共存的是( )
| A、Al3+、Na+、SO42-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、Ba2+、HCO3-、NO3-、K+ |