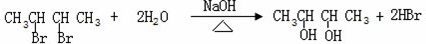题目内容
将0.1mol某有机物与0.3mol O2混合,于密闭反应器中用电火花点燃,将燃烧产物通入过量的澄清石灰水中,可得到沉淀20g,溶液质量减少5.8g;剩余气体继续通过灼热的CuO,可以使CuO质量减少1.6g,由此可知该有机物的分子式为( )
分析:将燃烧产物通入过量的澄清石灰水中,可得到沉淀20g为生成碳酸钙的质量,根据n=
计算碳酸钙的物质的量,再根据m=nM计算二氧化碳的质量,
溶液质量减少5.8g,生成的碳酸钙与燃烧生成的水、二氧化碳的质量之差为5.8g,据此计算燃烧生成水的质量,根据n=
计算燃烧生成水的物质的量,
该有机物的燃烧产物可以与CuO反应,说明有CO生成,根据反应中质量差计算生成CO的物质的量,根据原子守恒计算C、H原子物质的量,根据氧原子守恒计算含有氧原子的物质的量,
根据原子守恒计算有机物分子中C、H、O原子数目,据此确定有机物的分子式.
| m |
| M |
溶液质量减少5.8g,生成的碳酸钙与燃烧生成的水、二氧化碳的质量之差为5.8g,据此计算燃烧生成水的质量,根据n=
| m |
| M |
该有机物的燃烧产物可以与CuO反应,说明有CO生成,根据反应中质量差计算生成CO的物质的量,根据原子守恒计算C、H原子物质的量,根据氧原子守恒计算含有氧原子的物质的量,
根据原子守恒计算有机物分子中C、H、O原子数目,据此确定有机物的分子式.
解答:解:将燃烧产物通入过量的澄清石灰水中,可得到沉淀20g为生成碳酸钙的质量,其物质的量为
=0.2mo,根据碳原子守恒生成二氧化碳的物质的量为0.2mol,
该有机物的燃烧产物可以与CuO反应,说明有CO生成,可以使CuO质量减少1.6g,则:
CuO+CO
Cu+CO2,质量减少
1mol 16g
n(CO) 1.6g
则n(CO)=0.1mol,
故0.1mol有机物含有C原子为0.2mol+0.1mol=0.3mol,
溶液质量减少5.8g,则生成的碳酸钙与燃烧生成的水、二氧化碳的质量之差为5.8g,故燃烧生成水的质量为20g-0.2mol×44g/mol-5.8g=5.4g,故燃烧生成水的物质的量为
=0.3mol,
则0.1mol有机物含有H原子为0.3mol×2=0.6mol,
根据氧原子守恒可知,0.1mol有机物含有O原子的物质的量为0.2mol×2+0.1mol+0.3mol-0.3mol×2=0.2mol,
故有机物分子中N(C)=
=3、N(H)=
=6、N(O)=
=2
故有机物的分子式为C3H6O2,
故选C.
| 20g |
| 100g/mol |
该有机物的燃烧产物可以与CuO反应,说明有CO生成,可以使CuO质量减少1.6g,则:
CuO+CO
| △ |
1mol 16g
n(CO) 1.6g
则n(CO)=0.1mol,
故0.1mol有机物含有C原子为0.2mol+0.1mol=0.3mol,
溶液质量减少5.8g,则生成的碳酸钙与燃烧生成的水、二氧化碳的质量之差为5.8g,故燃烧生成水的质量为20g-0.2mol×44g/mol-5.8g=5.4g,故燃烧生成水的物质的量为
| 5.4g |
| 18g/mol |
则0.1mol有机物含有H原子为0.3mol×2=0.6mol,
根据氧原子守恒可知,0.1mol有机物含有O原子的物质的量为0.2mol×2+0.1mol+0.3mol-0.3mol×2=0.2mol,
故有机物分子中N(C)=
| 0.3mol |
| 0.1mol |
| 0.6mol |
| 0.1mol |
| 0.2mol |
| 0.1mol |
故有机物的分子式为C3H6O2,
故选C.
点评:本题考查有机物分子式的确定,难度中等,计算有机物燃烧生成水的质量是解题关键,注意掌握燃烧法根据原子守恒确定有机物分子式.

练习册系列答案
相关题目