题目内容
17.煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料.下列关于它们的综合利用叙述不正确的是( )| A. | 以煤、石油和天然气为主要原料生产的合成材料是塑料、合成橡胶、合成纤维 | |
| B. | 煤是工业上获得芳香烃的一种重要来源 | |
| C. | 石油的裂解是为了提高轻质油(例如汽油)的产量 | |
| D. | 天然气的主要成分是甲烷,属于不可再生资源 |
分析 A.合成材料又称人造材料,是人为地把不同物质经化学方法或聚合作用加工而成的材料;以石油、煤和天然气为主要原料生产的材料属于有机合成材料,如:塑料、合成橡胶、合成纤维,据此进行判断;
B、根据煤的用途;
C、根据石油裂化是提高轻质液体燃料的产量和质量,而石油裂解的目的是为了获得乙烯、丙烯、1,3-丁二烯等气态短链烃等加以判断;
D.天然气的主要成分是甲烷,属于不可再生资源.
解答 解:A.合成材料又称人造材料,是人为地把不同物质经化学方法或聚合作用加工而成的材料;以石油、煤和天然气为主要原料生产的材料属于有机合成材料,如:塑料、合成橡胶、合成纤维,故A正确;
B、因煤是工业上获得芳香烃的一种重要来源,故B正确;
C、根据石油裂化是提高轻质液体燃料的产量和质量,而石油裂解的目的是为了获得乙烯、丙烯、1,3-丁二烯等气态短链烃等,故C错误;
D.天然气的主要成分是甲烷,属于不可再生资源,故D正确;
故选C.
点评 本题主要考查了天然气、石油、煤的综合利用,难度不大,根据课本知识即可完成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液先加入足量氯水,溶液呈无色,然后滴加足量BaCl2溶液,得到沉淀4.66g,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为1.12L.
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
| A. | 原溶液一定存在NH4+、I- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、Fe3+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液所有的离子组成 |
2.如图是某患者在医院做的血常规检查报告单的部分内容:
该患者应该注意补充的微量元素是( )
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×10 12/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 钠 |
9.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
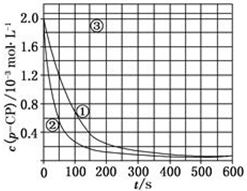 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
6.能正确表示下列反应的离子方程式是( )
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
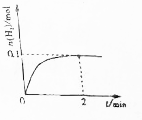 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol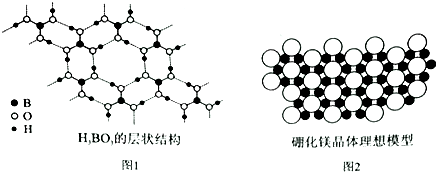 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.