题目内容
7.绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是( )| A. | 甲烷、CO合成乙酸乙酯:2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| B. | 烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 甲烷与氯气反应制氯仿:CH4+3Cl2$\stackrel{光照}{→}$CHCl3+3HCl | |
| D. | 乙烯合成聚乙烯 |
分析 由信息可知,“绿色化学”的特征为反应物中原子全部转化为欲制得的产物,即原子的利用率为100%,或生成物质只有一种,以此来解答.
解答 解:A.产物只有CH3OH一种,即原子的利用率为100%,符合“绿色化学”的思想,故A不选;
B.产物只有RCH2CH2CHO一种,即原子的利用率为100%,符合“绿色化学”的思想,故B不选;
C.甲烷发生取代反应生成CHCl3,一定还生成HCl,且取代反应为链锁反应,产物复杂,不符合“绿色化学”的思想,故C选;
D.产物只有聚乙烯一种,即原子的利用率为100%,符合“绿色化学”的思想,故D不选;
故选C.
点评 本题考查绿色化学及有机化学反应,为基础性习题,把握反应产物的种类与绿色化学的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
17.下列关于乙烯的叙述中,不正确的是( )
| A. | 乙烯的化学性质比乙烷活泼 | |
| B. | 乙烯燃烧时,火焰明亮,同时伴有黑烟 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色是由于发生了氧化反应 | |
| D. | 乙烯分子的双键中的一个键可以断裂,容易发生加成反应和取代反应 |
18.能正确表示下列反应的离子方程式是( )
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
15.0.5mol阿司匹林(学名为乙酰水杨酸,结构简式为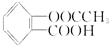 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
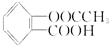 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 1.5mol | B. | 2 mol | C. | 1 mol | D. | 0.5 mol |
2.X元素最高价氧化物对应的水化物为H2XO3,它的气态氢化物为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
19.某有机物结构简式如图,有关它的说法正确的是( )


| A. | 它属于芳香烃 | B. | 1mol该物质能与6mol H2加成 | ||
| C. | 分子式为C14H8Cl5 | D. | 该有机易溶于水 |
16.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 28g乙烯和丙烯的混合物含有的碳原子数为为2NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
8.电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧-钠氧化法”回收Na2Cr2O7等物质.

已知:在水浸后的Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质.
(1)水浸后的溶液呈碱性(填“酸”、“碱”或“中”).
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式.
4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;中温\;}}{\;}$4Na2CrO4+4CO2+6H2O
(3)滤渣Ⅱ的主要成分有Zn(OH)2、Al(OH)3.
已知:①除去滤渣II后,溶液中存在如下反应:2Cr+2H+?Cr2+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
“系列操作”中为:继续加入H2SO4,蒸发浓缩,冷却结晶,过滤.继续加入H2SO4目的是促进平衡CrO42-+2H+?Cr2O72-+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7.
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式CrO42-+8H++6e-=Cr+4H2O.
(6)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33).当溶液pH=5时,某溶液中的Al3+能(填“能”或“不能”)完全沉淀.(溶液中的离子浓度小于1×10-5 mol•L-1时沉淀完全).

已知:在水浸后的Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质.
(1)水浸后的溶液呈碱性(填“酸”、“碱”或“中”).
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式.
4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;中温\;}}{\;}$4Na2CrO4+4CO2+6H2O
(3)滤渣Ⅱ的主要成分有Zn(OH)2、Al(OH)3.
已知:①除去滤渣II后,溶液中存在如下反应:2Cr+2H+?Cr2+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
温度 溶解度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式CrO42-+8H++6e-=Cr+4H2O.
(6)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33).当溶液pH=5时,某溶液中的Al3+能(填“能”或“不能”)完全沉淀.(溶液中的离子浓度小于1×10-5 mol•L-1时沉淀完全).