题目内容
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
| B、2L 0.5 mol?L-1硫酸钾溶液中阴离子所带电荷数为NA |
| C、1mol Na2O2固体中含离子总数为4NA |
| D、5NH4NO3═2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氢氧燃料电池中正极发生还原反应,所以正极原料为氧气,标况下22.4L氧气的物质的量为1mol,完全反应得到4mol电子;
B.硫酸钾中阴离子为 硫酸根离子,1mol硫酸根离子带有2mol负电荷;
C.过氧化钠中阴离子为 过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子;
D.该反应中生成4mol氮气,其中有3mol硝酸根离子被还原、5mol铵根离子被氧化,转移了15mol电子.
B.硫酸钾中阴离子为 硫酸根离子,1mol硫酸根离子带有2mol负电荷;
C.过氧化钠中阴离子为 过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子;
D.该反应中生成4mol氮气,其中有3mol硝酸根离子被还原、5mol铵根离子被氧化,转移了15mol电子.
解答:
解:A.标准状况下22.4L气体的物质的量为1mol,氢氧燃料电池的正极发生还原反应,正极为氧气,所以1mol氧气完全反应得到4mol电子,根据电子守恒,电路中通过的电子数目为4NA,故A错误;
B.2L 0.5 mol?L-1硫酸钾溶液中含有溶质硫酸钾1mol,1mol硫酸钾中含有1mol硫酸根离子,1mol硫酸根离子带有2mol负电荷,所带电荷数为2NA,故B错误;
C.1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol阴阳离子,含离子总数为3NA,故C错误;
D.28g氮气的物质的量为1mol,5NH4NO3═2HNO3+4N2↑+9H2O反应中,生成4mol氮气时,有5mol铵根离子被氧化,转移了5mol×3=15mol电子,若生成1mol氮气,转移的电子的物质的量为:15mol×
=3.75mol,转移的电子数目为3.75NA,故D正确;
故选D.
B.2L 0.5 mol?L-1硫酸钾溶液中含有溶质硫酸钾1mol,1mol硫酸钾中含有1mol硫酸根离子,1mol硫酸根离子带有2mol负电荷,所带电荷数为2NA,故B错误;
C.1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol阴阳离子,含离子总数为3NA,故C错误;
D.28g氮气的物质的量为1mol,5NH4NO3═2HNO3+4N2↑+9H2O反应中,生成4mol氮气时,有5mol铵根离子被氧化,转移了5mol×3=15mol电子,若生成1mol氮气,转移的电子的物质的量为:15mol×
| 1 |
| 4 |
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确过氧化钠中的阴离子为过氧根离子,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,正确分析反应或者的化合价变化为解答本题关键.

练习册系列答案
相关题目
下列有机物互为同系物的是( )
①CH2=CHCH2CH3 ②CH3CH2CH3 ③CH2=CHCH3 ④
①CH2=CHCH2CH3 ②CH3CH2CH3 ③CH2=CHCH3 ④

| A、①和④ | B、①和③ |
| C、②和④ | D、②和③ |
能够鉴别甲苯、己烯、苯酚溶液、AgNO3溶液、KI淀粉溶液五种无色液体的一种试剂是( )
| A、KMnO4酸性溶液 |
| B、溴水 |
| C、NaOH溶液 |
| D、FeCl3溶液 |
下列叙述不正确的是( )


| A、在核电站厂区,较多使用的安全标识是图2 |
| B、在垃圾分类中,废电池属于图4 |
C、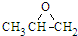 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物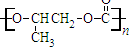 ,反应符合绿色化学的原则 ,反应符合绿色化学的原则 |
| D、图5 装置内发生的反应有化合、分解和置换反应 |
因在粮食增产方面作出巨大贡献而获得诺贝尔化学奖的科学家是( )
| A、袁隆平 | B、哈伯 |
| C、门捷列夫 | D、侯德榜 |
 如图表示一些物质间的从属关系,不正确的是( )
如图表示一些物质间的从属关系,不正确的是( )
| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 元素周期表的纵行 | 主族 | 副族 | 卤族 |
| C | 电解质 | 酸 | 碱 | 盐 |
| D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
| A、A | B、B | C、C | D、D |
C5H11Cl的同分异构体数为(不考虑立体异构)( )
| A、5 | B、6 | C、7 | D、8 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、2.8克乙烯和丙烯的混合气体中所含碳原子数为0.2 NA |
| B、0.1mol CnH2n+2含有C-C数为0.1nNA个 |
| C、标准状况下,22.4L CCl4含有NA个CCl4分子 |
| D、1mol苯乙烯含有的C=C数为4NA |