题目内容
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。
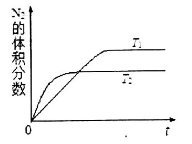
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃 料电池,可用作电解池的电源。其工作原理如图所示
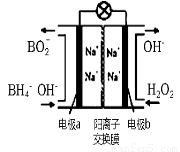
①写出a极上的电极反应式: ,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
(1)① > (1分) ②0.01 mol·L-1·s-1 (1分)(其它每空2分) 14.3%
(2)①SO2 + 2H2O – 2e-== SO42-+ 4H+ ②1:2
(3)BH4- + 8OH- - 8e- = BO2- + 6H2O (3分) MnO2对电极反应可能具有催化作用(2分)
【解析】
试题分析:(1)①根据题给图像知,温度为T2时先达到平衡状态,说明温度为T2时反应速率快,故温度:T1<T2,但温度为T2时反应达平衡时氮气的体积分数低,说明升高温度平衡向正反应方向进行,正方应是吸热反应,即△H>0。②根据公式v=△n/V△t将题给数据代入计算得υ(N2)=0.01 mol·L-1·s-1;平衡时氮气和氧气的浓度分别是5mol/L-0.5mol/L=4.5mol/L、2.5mol/L-0.5mol/L=2mol/L,NO的浓度是1mol/L,T3温度下该反应的化学平衡常数K=1/9,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则
N2 (g) + O2(g) 2NO(g)
2NO(g)
起始浓度(mol/L)0.5 0.5 0
转化浓度(mol/L)x x 2x
平衡浓度(mol/L)0.5-x 0.5-x 2x
代入平衡常数表达式 =1/9 ,解得x=1/14,达到平衡后N2的转化率为14.3%;
=1/9 ,解得x=1/14,达到平衡后N2的转化率为14.3%;
(2)①根据题给装置图分析,SO2在电解池的阳极发生氧化反应生成硫酸,电极反应式是SO2+2H2O-2e-=4H++SO42-;②阴极排除的是S2O42-在与NO2的反应中S元素化合价从+3价升高到+4价,失去1个电子,则1molS2O42-失去2mol电子。NO2转化为无毒的气体应该是氮气,反应中氮元素化合价从+4价降低到0价,得到4个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比为1:2。
(3)①以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,分析题给装置图知,a极上的电极反应为碱性条件下,BH4—失电子转化为BO2—和水,氢元素的化合价由—1价升高到+1价,电极反应式:BH4- + 8OH- - 8e- = BO2- + 6H2O,②正极反应为过氧化氢得电子生成氢氧根,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为MnO2对电极反应可能具有催化作用。
考点:考查化学平衡图像和计算,氧化还原反应的计算,电化学原理。

| A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、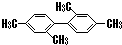 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol有机物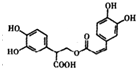 一定条件下能和7molNaOH反应. 一定条件下能和7molNaOH反应. |


 2 C(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。
2 C(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。

 cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是