题目内容
下列关于浓HNO3与浓H2SO4的叙述正确的是( )
| A、常温下都可用铁制容器贮存 |
| B、常温下都能与铜较快反应 |
| C、露置于空气中,溶液质量均减轻 |
| D、露置于空气中,溶液浓度均升高 |
考点:硝酸的化学性质,浓硫酸的性质
专题:元素及其化合物
分析:A.常温下,Fe、Al在浓硝酸、浓硫酸中发生钝化现象;
B.常温下浓硝酸能与铜较快反应,浓硫酸与铜在常温下不反应;
C.浓硝酸易挥发,且见光易分解;浓硫酸具有吸水性;
D.浓硝酸易挥发,且见光易分解;浓硫酸具有吸水性.
B.常温下浓硝酸能与铜较快反应,浓硫酸与铜在常温下不反应;
C.浓硝酸易挥发,且见光易分解;浓硫酸具有吸水性;
D.浓硝酸易挥发,且见光易分解;浓硫酸具有吸水性.
解答:
解:A.常温下,Fe、Al在浓硝酸、浓硫酸中发生钝化现象,常温下都可用铁制或铝制容器贮存,故A正确;
B.常温下浓硝酸能与铜较快反应,浓硫酸与铜在常温下不反应,故B错误;
C.浓硝酸易挥发,且见光易分解,溶液的质量减小,而浓硫酸具有吸水性使溶液的质量增加,故C错误;
D.浓硝酸易挥发,且见光易分解,溶液的浓度减小,浓硫酸具有吸水性,使溶液的浓度减小,故D错误,
故选A.
B.常温下浓硝酸能与铜较快反应,浓硫酸与铜在常温下不反应,故B错误;
C.浓硝酸易挥发,且见光易分解,溶液的质量减小,而浓硫酸具有吸水性使溶液的质量增加,故C错误;
D.浓硝酸易挥发,且见光易分解,溶液的浓度减小,浓硫酸具有吸水性,使溶液的浓度减小,故D错误,
故选A.
点评:本题考查浓硫酸与浓硝酸的性质,难度不大.旨在考查学生对基础知识的理解掌握,注意浓硫酸和硝酸的特性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是( )
在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是( )| A、铁端将附着铜增重下沉 |
| B、铜端将附着铜增重下沉 |
| C、铁端将变细减重上升 |
| D、铜端粗细不变将下沉 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,6g二氧化硅含有Si-O键数目为2NA |
| B、54克Al与氢氧化钠反应产生气体67.2L |
| C、Na与足量O2反应生成1mol Na2O或1mol Na2O2均失去2NA电子 |
| D、各5.6g铁分别与足量的盐酸反应,电子转移总数均为0.3NA |
下列各组物质互为同分异构体的是( )
| A、12C和14C |
| B、水和水银 |
| C、石墨和金刚石 |
| D、CH3CH2CH2CH3和(CH3)2CHCH3 |
下列与化学实验有关的说法正确的是( )
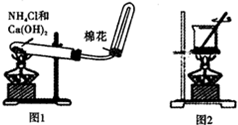

| A、用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色火焰,则该溶液中一定不含K+ |
| B、将氯水点到蓝色石蕊试纸上,试纸接触点先变红后褪色,说明氯水中含H+具有酸性,含Cl2而具有漂白性 |
| C、如图1装置可用于实验室制备氨气 |
| D、如图2装置可灼烧海带成灰 |
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
| A、Mg(OH)2 |
| B、Al(OH)3 |
| C、SiO2 |
| D、SO2 |
下列说法正确的是( )
| A、Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 |
| B、水银、水玻璃、胆矾都是纯净物 |
| C、HCl、NH3、BaSO4都是电解质 |
| D、丁达尔现象可以用来区别胶体和溶液 |
某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ/mol(Q>0)达到平衡.缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大.以下分析正确的是( )
| A、产物B的状态只能为固态或液态 |
| B、平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
| C、保持体积不变,向平衡体系中加入B,平衡不可能向逆反应方向移动 |
| D、若开始时向容器中加入1mol B和1mol C,达到平衡时放出热量QkJ |
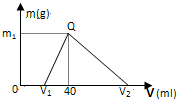 (1)15.6g Na2X含Na+0.4moL,则Na2X的摩尔质量为
(1)15.6g Na2X含Na+0.4moL,则Na2X的摩尔质量为