题目内容
11.取相同体积的KI、Na2S、FeBr2溶液,分别通入足量氯气,当反应恰好完成时三种溶液消耗氯气的体积相同(同温,同压条件下).则KI、Na2S、FeBr2溶液的物质的量浓度之比为( )| A. | 6:3:2 | B. | 1:2:3 | C. | 3:6:2 | D. | 2:1:3 |
分析 根据通入足量氯气,当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2S、FeBr2失去的电子数相等,又溶液的体积相同,则浓度之比等于物质的量之比.
解答 解:因KI、Na2S、FeBr2溶液,分别通入足量氯气均发生氧化还原反应,
且反应恰好完全时,三种溶液消耗氯气的物质的量相同,
则KI、Na2S、FeBr2失去的电子数相等,
设KI、Na2S、FeBr2的物质的量分别为x、y、z,
由失去的电子数相等可知,
x×(1-0)=y×[0-4(-2)]=z×(3-2)+z×2×(1-0),
解得x:y:z=6:3:2,
故选A.
点评 本题考查了氯气的性质,侧重考查氧化还原反应知识考查,明确氧化还原反应中电子守恒是解答本题的关键,注意FeBr2中Fe、Br都失去电子是学生解答中的难点和易错点,题目难度中等.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
1.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如下表所示,X与Z形成的化合物常用于漂白纸张.下列说法正确的是( )
| X | W | |||
| Y | Z |
| A. | X元素形成的氢化物液态比固态的密度小 | |
| B. | 四种元素行成的简单离子半径从大小的排列顺序Y>Z>X>W | |
| C. | 常温下,Y形成的简单离子和W形成的简单离子在水溶液中可以大量共存 | |
| D. | Y常用于冶炼难熔的金属 |
2.工业上可通过电解NO制备NH4NO3,其工作原理如图所示.下列说法不正确的是( )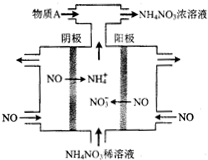

| A. | NO是常见的大气污染物之一,该装置可实现废气的治理与回收利用 | |
| B. | 阳极反应为:NO-3e-+2H2O═NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+═NH4++H2O | |
| D. | 为使电解产物全部转化为NH4NO3,需向该电解池中补充水 |
19.利用如图装置可以验证NH3和HCl的有关性质.下列有关说法不正确的是( )

| A. | 关闭活塞c,打开活塞a、b,挤压胶头滴管,Ⅱ中产生喷泉 | |
| B. | 关闭活塞a,打开活塞b、c,用热毛巾敷热烧瓶I,I中产生喷泉 | |
| C. | 关闭活塞b,打开活塞a、c,用热毛巾敷热烧瓶II,I中会产生白雾 | |
| D. | 关闭活塞b,打开活塞a、c,用热毛巾敷热烧瓶II,一段时间后,打开活塞b,I、II中均产生喷泉 |
16.下列有关物质的表达式正确的是( )
| A. | 苯的最简式:C6H6 | B. | 乙烯分子的结构简式为:CH2CH2 | ||
| C. | 一氯甲烷的电子式为: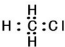 | D. | 2-甲基丁烷的键线式: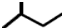 |
3.金属一般具有的性质是( )
| A. | 在反应中作氧化剂 | B. | 原子中电子的个数比较少 | ||
| C. | 熔、沸点都比较高 | D. | 能导电、导热,有延展性 |
20.下列与蛋白质的变性无关的是( )
| A. | 甲醛溶液浸泡生物样本 | |
| B. | 强酸、强碱对蛋白质的腐蚀 | |
| C. | 重金属盐使人和动物中毒 | |
| D. | 浓的硫酸铵溶液使鸡蛋清溶液析出固体 |
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: