题目内容
8.下列说法中正确的是( )| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | 含有离子键的物质一定是离子化合物 | |
| D. | 氦分子中含有共价键 |
分析 共价化合物中原子间以共用电子对形成化学键,属于共价键,离子化合物中一定含有离子键,可能含有共价键,以此解答该题.
解答 解:A.氯气等双原子分子中含共价键,但是单质,故A正确;
B.只存在共价键的物质可以是共价化合物或非金属单质,故B错误;
C.离子化合物中一定含有离子键,所以含有离子键的物质一定是离子化合物,故C正确;
D.氦分子中不存在任何化学键,故D错误.
故选C.
点评 本题考查化学键及化合物的类别,为高频考点,熟悉化学键的形成及特殊物质中的化学键即可解答,注意利用实例来分析解答.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
18.下列表述正确的是( )
| A. | 次氯酸的电子式: | B. | 14C的原子结构示意图: | ||
| C. | 188O2- 离子结构示意图: | D. | CO2的结构示为:O═C═O |
19.已烯雌酚(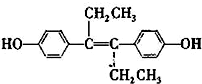 )是一种激素类药物,下列说法不正确的是( )
)是一种激素类药物,下列说法不正确的是( )
 )是一种激素类药物,下列说法不正确的是( )
)是一种激素类药物,下列说法不正确的是( )| A. | 已烯雌酚的分子式为C18H20O2,它为芳香族化合物 | |
| B. | 已烯雌酚分子中一定有16个碳原子共平面 | |
| C. | 1 mol已烯雌酚可以与5 mol Br2发生反应 | |
| D. | 已烯雌酚能发生加成、取代、氧化、加聚、酯化反应 |
16.关于有机物的下列说法正确的是( )
| A. | 葡萄糖分子式为C6H12O6,是一种己醛糖,它是最简单的醛糖 | |
| B. | 人造丝、人造棉、铜氨纤维、醋酸纤维的主要成分均为纤维素 | |
| C. | 红外光谱仪、核磁共振氢谱仪、质谱仪都可用于有机物的结构分析 | |
| D. | 蛋白质的二级结构主要依靠不同肽链间亚氨基上的H与羰基上的O形成氢键而实现的 |
3.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s 时生成0.1mol H2,则表示该时段的化学反应速率正确的是( )
| A. | v(HI)=0.8 mol•Lˉ1•sˉ1 | B. | v(I2)=0.2 mol•Lˉ1•sˉ1 | ||
| C. | v(HI)=0.1 mol•Lˉ1•minˉ1 | D. | v(H2)=0.05 mol•Lˉ1•sˉ1 |
20.某微粒用${\;}_{Z}^{A}$Rn+表示,下列关于这种微粒的叙述正确的是( )
| A. | 所含质子数Z+A | B. | 所含电子数Z+n | C. | 所含中子数 A-Z | D. | 质量数Z |
13.高中化学教材中有很多重要的演示或改编实验,就下列提供的几套装置回答有关问题:

(一)对于实验装置Ⅰ:
(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为用小试管收集一试管氢气,点燃,听声音,若发出轻微的“噗”的声音,则说明氢气已纯,或发出尖锐的爆鸣声则说明氢气不纯.
(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:
Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是氢气中混有乙醇蒸气.
(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:
(3)仪器a的名称为分液漏斗
(4)关闭K1、打开K2,D中的现象为无明显变化.
(5)E中发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+;检验E中有无SO42-生成,用到的试剂有盐酸、氯化钡(填化学式).
(6)整个装置Ⅱ的明显不足之处在于没有尾气吸收装置.
(三)运用装置Ⅲ探究反应速率的影响因素:
(7)该组实验的目的是比较不同浓度的草酸对反应速率的影响;表中V=9mL
(8)有同学观察实验①过程中产生气泡的快慢,得出以下变化(如图甲):

则图甲中AB段变化的主要原因是锰离子对反应有催化作用;另有别的实验小组在完成Zn粒与稀硫酸反应的实验过程中,观察产生氢气的体积与时间的关系,有类似于图甲的规律,如图乙所示,则CD段变化的主要原因是使温度升高,反应速率增大.

(一)对于实验装置Ⅰ:
(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为用小试管收集一试管氢气,点燃,听声音,若发出轻微的“噗”的声音,则说明氢气已纯,或发出尖锐的爆鸣声则说明氢气不纯.
(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:
Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是氢气中混有乙醇蒸气.
(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:
(3)仪器a的名称为分液漏斗
(4)关闭K1、打开K2,D中的现象为无明显变化.
(5)E中发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+;检验E中有无SO42-生成,用到的试剂有盐酸、氯化钡(填化学式).
(6)整个装置Ⅱ的明显不足之处在于没有尾气吸收装置.
(三)运用装置Ⅲ探究反应速率的影响因素:
| 试管编号 | 0.01mol/LKMnO4 | 0.5mol/LH2SO4 | 0.2mol/LH2C2O4 | H2O | 褪色时间/s |
| ① | 4mL | 5mL | 2mL | VmL | t1 |
| ② | 4mL | 5mL | 4mL | 7mL | t2 |
| ③ | 4mL | 5mL | 6mL | 5mL | t3 |
(8)有同学观察实验①过程中产生气泡的快慢,得出以下变化(如图甲):

则图甲中AB段变化的主要原因是锰离子对反应有催化作用;另有别的实验小组在完成Zn粒与稀硫酸反应的实验过程中,观察产生氢气的体积与时间的关系,有类似于图甲的规律,如图乙所示,则CD段变化的主要原因是使温度升高,反应速率增大.