题目内容
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):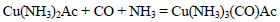
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 。
(2)写出基态Cu+的核外电子排布式 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 。
(4)写出与CO互为等电子体的离子 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为 ;1 mol尿素分子中,σ键的数目为 。
(1)N>O>C (2)[Ar]3d10 (3)4 (4)CN- (5)sp2杂化、sp3杂化;4.214×1024
【解析】
试题分析:(1)一般来说非金属性越强,第一电离能大,所以O>N>C,但是因为p轨道半充满体系具有很强的稳定性,N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子,故答案为N>O>C(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10,故答案为[Ar]3d10(3)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为4(4)等电子体为核外电子数相同的粒子,羰基为14个电子,如CN-也为14个电子,故答案为CN-(5)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2,中心原子为氮,氮原子含有3个共价键和一个孤电子对氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3;σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为 7NA故答案为sp2、sp3;7NA。
考点:物质的结构与性质之间的关系;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案






