题目内容
(1)将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有______产生,它们的离子反应方程式______.
(2)锌粒投入稀硫酸中,溶液里______离子的量减少,______离子的量增加,______离子的量没有变化.
解:(1))将AgNO3溶液分别与HCl、NaCl、KCl溶液混合后,银离子和氯离子反应会生成氯化银白色沉淀,实质是:Ag++Cl-═AgCl↓,故答案为:白色沉淀;Ag++Cl-═AgCl↓;
(2)金属锌和硫酸的反应实质为:Zn+2H+=Zn2++H2↑,所以氢离子的量减少,锌离子的量增加,硫酸根离子没有参与反应,其量没有变化,故答案为:H+;Zn2+;SO42-.
分析:(1)银离子和氯离子反应会生成氯化银白色沉淀;
(2)金属锌可以和强酸反应生成锌盐和氢气,根据离子方程式来回答.
点评:本题考查学生离子方程式的书写知识,是现在考试的热点,难度不大.
(2)金属锌和硫酸的反应实质为:Zn+2H+=Zn2++H2↑,所以氢离子的量减少,锌离子的量增加,硫酸根离子没有参与反应,其量没有变化,故答案为:H+;Zn2+;SO42-.
分析:(1)银离子和氯离子反应会生成氯化银白色沉淀;
(2)金属锌可以和强酸反应生成锌盐和氢气,根据离子方程式来回答.
点评:本题考查学生离子方程式的书写知识,是现在考试的热点,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 AgOH+H+
AgOH+H+
 门上的固体材料R可以采用
门上的固体材料R可以采用 方向为
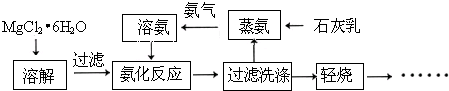
方向为 已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl═AgCl↓+KNO3.将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl═AgCl↓+KNO3.将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题: