题目内容
15.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 含有1molFe(OH)3的氢氧化铁胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 1mol-L-1Na2CO3溶液100mL,含有0.1NA个CO32- | |
| C. | 足量的铁与1molCl2充分反映转移的电子数为3NA | |
| D. | 高温常压下,22.4L的一氯甲烷中含有的分子数小于NA个 |
分析 A.氢氧化铁胶体为氢氧化铁的聚集体,无法计算胶粒数目;
B.碳酸根离子部分水解,导致醋酸根离子数目减少;
C.1mol氯气完全反应生成氯化铁,最多得到2mol电子;
D.该条件下气体摩尔体积大于22.4L/mol,则22.4L气体的物质的量小于1mol.
解答 解:A.由于氢氧化铁胶粒为氢氧化铁的聚集体,则无法计算含有的胶粒数目,故A错误;
B.100mL 1mol/L的碳酸钠溶液中含有0.1mol溶质碳酸钠,由于碳酸根离子部分水解,则溶液中含有的碳酸根离子小于0.1mol,则含有的碳酸根离子的数目小于0.1NA,故B错误;
C.足量的铁与1molCl2充分反应,1mol氯气最多得到2mol电子,则转移的电子数为2NA,故C错误;
D.高温常压下,气体摩尔体积大于22.4L/mol,则该条件下22.4L一氯甲烷的物质的量小于1mol,含有的一氯甲烷的分子数小于NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,明确标况下气体摩尔体积的使用条件.

练习册系列答案
相关题目
5.下列事实与胶体性质关的是( )
| A. | 工业生产中常用静电除尘装置除去废气中的固体悬浮物 | |
| B. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| C. | 一束平行光线照射豆浆时,可看到光亮的通路 | |
| D. | 万里长江流入大海处,形成长江三角洲 |
3.下列实验结论不正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 将石蜡油加强热(裂解)所产生的气体通入酸性高锰酸钾溶液中 | 溶液褪色 | 产物不都是烷烃 |
| B | 向盛有3mL鸡蛋清溶液的试管里,滴入几滴浓硝酸 | 鸡蛋清变黄色 | 蛋白质可以发生颜色反应 |
| C | 将碘酒滴到新切开的土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D、 |
10.实验室中准备有以下主要仪器及用品,大试管、带导管的单孔塞、药匙、镊子、水槽、集气瓶、玻璃片、酒精灯、铁架台,如果药品选用合理,用以上仪器用品,能完成的实验有( )
| A. | 制取一氧化氮 | B. | 制取乙烯 | C. | 制取乙炔 | D. | 氢气还原氧化铜 |
20.下列实验装置及描述正确的是( )
| A. |  该图装置不能这么碳酸与苯酚的酸性强弱 | |
| B. | 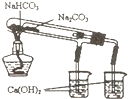 该图可验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 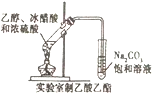 实验室可用该装置制取少量的乙酸乙酯 | |
| D. | 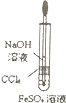 该图装置可用于制备Fe(OH)2 |
4.已知某酸H2B在水溶液中存在下列关系::①H2B?H++HB-,②HB-?H++B2-.则下列关于酸式盐NaHB的溶液
的说法中一定正确的是( )
的说法中一定正确的是( )
| A. | NaHB的电离方程式为:NaHB?Na-+H-+B2- | |
| B. | NaHB溶液一定呈酸性 | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H20 | |
| D. | NaHB溶液中一定存在:c(Na+)+c(H+)═c(HB-)+2c(B2-)+c(OH-) |
 ,结构简式H2C=CH2.
,结构简式H2C=CH2.
 ,反应类型是加聚反应.
,反应类型是加聚反应.