题目内容
(1)①0.01mol/LNaOH 溶液的pH= 。
溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4种离子:X+、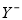 、H+、OH-下列分析结果肯定错误的是( )。
、H+、OH-下列分析结果肯定错误的是( )。
A.CY->CX+>CH+>COH-  B.CX+>CY->COH->CH+
B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是(  )
)
A.C(CH3COO-)<C(Na+)
B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH)
D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
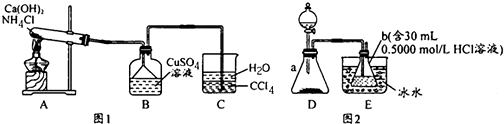
4.利用实验器材(规格和数量不限)能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol•L-1的溶液 |
| D | 烧杯、分液漏斗 | 用CCl4分离碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |


 Na2O2 C.H3O+ D.MgO
Na2O2 C.H3O+ D.MgO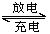 PbSO4+2H2O的说法正确的是
PbSO4+2H2O的说法正确的是