题目内容
下列物质在空气中久置变质,并且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
| A、苛性钠溶液 | B、漂白粉 |
| C、碳酸钠 | D、氢硫酸 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:发生的反应中,存在元素的化合价变化为氧化还原反应,反之不是,以此来解答.
解答:
解:A.发生2NaOH+CO2═Na2CO3+H2O,没有元素的化合价变化,属于非氧化还原反应,故A不选;
B.漂白粉的有效成分为次氯酸钙,次氯酸钙在空气中容易与二氧化碳反应生成次氯酸,反应为CO2+H2O+Ca(ClO)2═CaCO3+2HClO,属于非氧化还原反应;次氯酸不稳定,见光分解,导致漂白粉失效,次氯酸分解的方程式为:2HClO
2HCl+O2↑,Cl、O元素的化合价变化,为氧化还原反应,故B选;
C.发生Na2CO3+CO2+H2O=2NaHCO3,没有元素的化合价变化,属于非氧化还原反应,故C不选;
D.发生O2+2H2S=S+2H2O,O、S元素的化合价变化,为氧化还原反应,故D不选;
故选B.
B.漂白粉的有效成分为次氯酸钙,次氯酸钙在空气中容易与二氧化碳反应生成次氯酸,反应为CO2+H2O+Ca(ClO)2═CaCO3+2HClO,属于非氧化还原反应;次氯酸不稳定,见光分解,导致漂白粉失效,次氯酸分解的方程式为:2HClO
| ||
C.发生Na2CO3+CO2+H2O=2NaHCO3,没有元素的化合价变化,属于非氧化还原反应,故C不选;
D.发生O2+2H2S=S+2H2O,O、S元素的化合价变化,为氧化还原反应,故D不选;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列过程需要通电后才可以发生或进行的是( )
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
| A、①② | B、②③④ |
| C、②③④⑤ | D、全部 |
在室温下pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )
| A、9:1 | B、1:11 |
| C、1:9 | D、11:1 |
关于下列装置说法正确的是( )
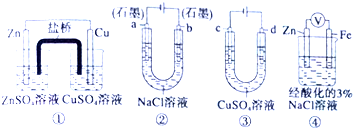

| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、用装置③精炼铜时,c极为粗铜 |
| C、装置②工作一段时间后,a极附近溶液的pH增大 |
| D、装置④中电子Zn流向Fe,装置中有Fe2+生成 |
关于食物的酸碱性,下列说法不正确的是( )
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、由碳、氮、硫、磷等组成的蛋白质是酸性食物 |
| C、蔬菜、水果多含钾、钠、钙、镁等盐类,习惯称为碱性食物 |
| D、柠檬酸属于碱性食物 |
下列说法正确的是( )
| A、Na2O2、Na2O均能吸收CO2并放出氧气 |
| B、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C、Na比Cu活泼,将Na投入CuSO4溶液中会有铜析出 |
| D、从lL lmol?L-1的H2SO4溶液中取出10 mL,其中H+浓度为2mol?L-1 |
下列有关pH或c(H+)变化的判断中,正确的是( )
| A、其他条件不变,温度的升高,纯水的pH不变 |
| B、其他条件不变,加水稀释后,碳酸钠溶液的c(H+)减小 |
| C、其他条件不变,温度的升高,碳酸溶液的c(H+)基本不变 |
| D、其他条件不变,常温pH=5的盐酸稀释1000倍后,溶液的pH变为8 |
下列化学及实验用语书写正确的是( )
| A、崔化剂 | B、椎形瓶 |
| C、蒸发皿 | D、粹取 |