题目内容
6.下列粒子中,与NH4+的质子数和电子数都相等的是( )| A. | OH- | B. | H3O+ | C. | CH4 | D. | HF |
分析 由于N的质子数为7,H的质子数为1,所以NH4+中质子数为11,电子数为10个.对于电中性原子:质子数=电子数,阳离子:质子数-所带电荷数目=电子数;阴离子:质子数+所带电荷数目=电子数.
解答 解:NH4+中氮原子质子数为7,H原子质子数为1,故NH4+中质子数=7+1×4=11,电子数=11-1=10;
A.OH-中具有9个质子和10个电子,故A不选;
B.H3O+中具有11个质子和10个电子,故B选;
C.CH4中具有10个质子和10个电子,故C不选;
D.HF中具有10个质子和10个电子,故D不选.
故选B.
点评 本题考查微粒中的质子数和电子数,学生应注意中性微粒质子数等于电子数,离子中质子数≠电子数±电荷数,题目难度不大.

练习册系列答案
相关题目
17.生活中处处有化学,下列有关说法正确的是( )
| A. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| B. | 淀粉和纤维素均为天然高分子化合物 | |
| C. | 凡含有食品添加剂的食物均不可食用 | |
| D. | 大米煮成粥后,淀粉就变成了葡萄糖 |
14.现有硫酸钠、硫酸铝、硫酸镁三种无色溶液,若有一种试剂将它们区别开来,该试剂是( )
| A. | 纯水 | B. | 盐酸 | C. | 硝酸银溶液 | D. | 氢氧化钠溶液 |
1.下列仪器的使用、实验药品选择或实验现象描述正确的是( )
| A. | 物质的分离提纯方法之一为“筛分”,如:胶体--渗析法提纯,浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒和滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 工业上电解饱和食盐水时,为了阻止产物相互之间反应,往往用阴离子交换膜把阳极和阴极隔开 | |
| D. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,可验证Na2S2O3浓度对反应速率的影响 |
11.如图为一重要的有机化合物,以下关于它的说法中正确的是( )


| A. | 它是芳香烃 | |
| B. | 1mol该物质,最多可以与1mol H2发生加成反应 | |
| C. | 与1mol该物质反应,消耗Na、NaOH、NaHCO3 的物质的量之比为2:1:1 | |
| D. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
18.类推是中学化学中重要的思维方法.下列类推结论正确的是( )
| A. | 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg | |
| B. | Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu | |
| C. | 铝和硫加热得到Al2S3,故铁和硫加热得到Fe2S3 | |
| D. | CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2 |
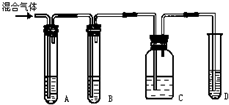
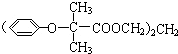 ,可用于降低血液中的胆固醇,该物质合成线路如图所示:
,可用于降低血液中的胆固醇,该物质合成线路如图所示: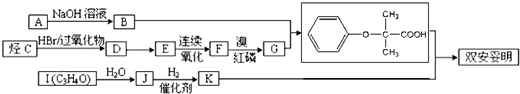
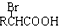 $\stackrel{苯酸钠}{→}$
$\stackrel{苯酸钠}{→}$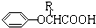
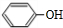 .
.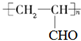
 +K→双安妥明”的化学方程式为
+K→双安妥明”的化学方程式为 .
.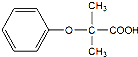 的同分异构体有6种(不考虑立体异构)
的同分异构体有6种(不考虑立体异构)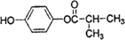 (写结构简式).
(写结构简式). .
.