题目内容
2.将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位,炼铁高炉中发生的关键反应如下.C(s)+O2(g)=CO2(g)△H=-393.5 kJ•mol-1
CO2(g)+C(s)=2CO(g)△H=172.46 kJ•mol-1
Fe2O3+CO→Fe+CO2
已知:2Fe(s)+3/2O2(g)=Fe2O3 (s)△H=-824.21kJ•mol-1,
根据以上三个热化学方程式,回答下列问题:
(1)CO的燃烧热为282.98KJ/mol,写出其热化学方程式CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.98KJ/mol;
(2)写出高炉内Fe2O3被CO还原为Fe的热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.74kJ•mol-1.
(3)炼制1 t(吨)含铁96%的生铁所需焦炭的理论用量是0.3086t,实际生产中所需焦炭远高于理论用量,其原因是焦炭没有被充分利用.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式和盖斯定律计算得到;
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H=172.46kJ•mol-1
③2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-824.21kJ•mol-1
则根据盖斯定律①×$\frac{3}{2}$-②×$\frac{3}{2}$+③进行分析计算;
(3)根据炼铁的方程式2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2进行计算.
解答 解:(1)①C(s)+O2(g)=CO2(g)△H=-393.5 kJ•mol-1
②CO2(g)+C(s)=2CO(g)△H=172.46 kJ•mol-1
依据盖斯定律计算①-②得到:2CO(g)+O2(g)=2CO2(g)△H=-565.96KJ/mol,
依据燃烧热概念可知,一氧化碳燃烧热为282.98KJ/mol,热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.98KJ/mol,
故答案为:282.98KJ/mol,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.98KJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H=172.46kJ•mol-1
③2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-824.21kJ•mol-1
则根据盖斯定律①×$\frac{3}{2}$-②×$\frac{3}{2}$-③,得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-393.5×$\frac{3}{2}$-172.46×$\frac{3}{2}$+824.2=-24.74kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.74kJ•mol-1;
(3)设CO质量为x
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
84 112
x 0.96t
x=0.72t
设C的质量为y
2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO
24 56
y 0.72t
y=0.3086t
又焦炭没有被充分利用,所以实际生产中所需焦炭远高于理论用量,
故答案为:0.3086;焦炭没有被充分利用.
点评 本题考查盖斯定律的应用以及化学方程式的有关计算,正确应用盖斯定律是解本题关键,题目难度不大.

 阶梯计算系列答案
阶梯计算系列答案| A. | 0.3mol•L-1 的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol | |
| B. | 当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L氨气溶于水制得1L氨水时,其浓度才是1mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相等 | |
| D. | 10℃时,0.35mol/L的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol/L |
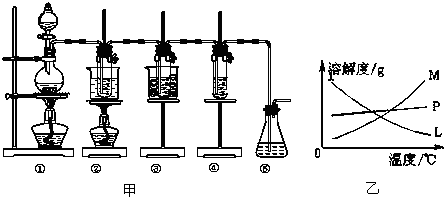
图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①浓盐酸挥发变稀,②反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱.
反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是M(填写编号字母);
从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成次氯酸具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |

