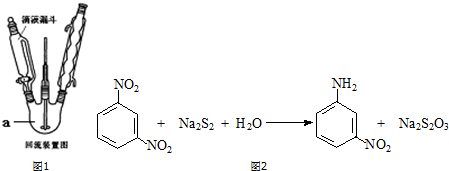题目内容
12.形成下列分子时,一个原子用sp2杂化轨道和另一个原子的p轨道成键的是( )| A. | BF3 | B. | CCl4 | C. | NH3 | D. | H2O |
分析 形成分子时,一个原子用sp2杂化轨道和另一个原子的p轨道成键,说明一个原子中价层电子对个数是3、另一个原子中未成对电子是p电子,据此分析解答.
解答 解:形成分子时,一个原子用sp2杂化轨道和另一个原子的p轨道成键,说明一个原子中价层电子对个数是3、另一个原子中未成对电子是p电子,
A.该分子中B原子价层电子对个数是3,F原子中未成对电子是p电子,所以B原子采用sp2杂化与F原子的p轨道成键,故A正确;
B.该分子中C原子价层电子对个数是4,所以C原子采用sp3杂化,故B错误;
C.该分子中N原子价层电子对个数是4,H原子未成对电子是s电子,则N原子采用sp3杂化与H原子的s轨道成键,故C错误;
D.该分子中O原子价层电子对个数是4,H原子未成对电子是s电子,则O原子采用sp3杂化与H原子的s轨道成键,故D错误;
故选A.
点评 本题考查原子杂化判断,为高频考点,明确价层电子对互斥理论是解本题关键,难点是价层电子对个数的计算方法,题目难度不大.

练习册系列答案
相关题目
17.能够快速、微量、精确的测定有机物相对分子质量的物理方法是( )
| A. | 核磁共振谱 | B. | 红外光谱 | C. | 质谱 | D. | 紫外光谱 |
4.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是( )
| A. | CH2=CH-CH2CH2Cl | B. | (CH3)3CCH2OH | C. | CH3CHClCHO | D. | CH2=CHCH2COOCH3 |
1.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)燃料的电池装置如图装置①该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列叙述不正确的是( )

| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生1molCl2至少需要通入0.5molN2H4 | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
8.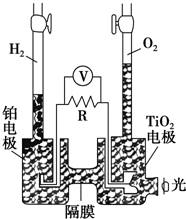 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
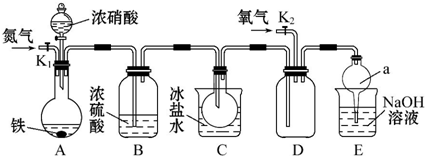
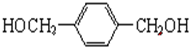 .
.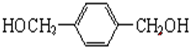 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$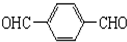 +2H2O.
+2H2O. .(原子量:Ag--108)
.(原子量:Ag--108)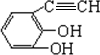 (只写出一种即可).
(只写出一种即可).