题目内容
看图填空:
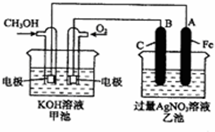
(1)请回答图中甲、乙池的名称.甲池是
(2)A(石墨)电极的名称是
(3)通入CH3OH的电极的电极反应式为
(4)乙池中反应的化学方程式为
(5)当乙池中B极的质量增加5.40g时,甲池中理论上消耗O2
A.MgSO4 B.CuSO4 C.Na2SO4 D.AgNO3.

(1)请回答图中甲、乙池的名称.甲池是
原电池
原电池
装置.乙池是电解池
电解池
装置.(2)A(石墨)电极的名称是
阳极
阳极
.(3)通入CH3OH的电极的电极反应式为
CH3OH+8OH-6e-═CO32-+6H2O
CH3OH+8OH-6e-═CO32-+6H2O
.(4)乙池中反应的化学方程式为
4AgNO3+2H2O
4Ag+O2↑+4HNO3
| ||
4AgNO3+2H2O
4Ag+O2↑+4HNO3
.
| ||
(5)当乙池中B极的质量增加5.40g时,甲池中理论上消耗O2
280
280
mL(标准状况下),乙池溶液pH大约是1
1
(溶液体积为500mL);此时丙池某电极析出1.60g某金属,则丙池的某盐溶液可能是BD
BD
(填序号)A.MgSO4 B.CuSO4 C.Na2SO4 D.AgNO3.

分析:甲中负极为甲醇,正极为氧气,为原电池,负极反应为CH3OH+8OH-6e-═CO32-+6H2O,乙为电解池,A与原电池的正极相连,则A为阳极,发生4AgNO3+2H2O
4Ag+O2↑+4HNO3,乙中B极析出Ag,阴极生成氧气,利用电子守恒可知,O2~4Ag~4HNO3,丙池某电极析出1.60g某金属,氧化性比氢离子强的金属离子均可能,以此来解答.
| ||
解答:解:(1)由图可知,甲为燃料电池,则为原电池,甲为乙的电源,则乙为电解池,故答案为:原电池;电解池;
(2)A与原电池的正极相连,A(石墨)电极的名称是阳极,故答案为:阳极;
(3)通入CH3OH的电极为负极,失去电子,则电极反应式为CH3OH+8OH-6e-═CO32-+6H2O,故答案为:CH3OH+8OH-6e-═CO32-+6H2O;
(4)乙为电解池,A与原电池的正极相连,则A为阳极,溶液中银离子、氢氧根离子放电,发生4AgNO3+2H2O
4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3;
(5)由电子守恒可知,O2~4Ag~4HNO3,n(O2)=
×
=0.0125mol,标况下的体积为0.0125mol×22.4L/mol=0.28L=280mL,
n(HNO3)=0.05mol,则c(HNO3)=
=0.1mol/L,pH=1,丙池某电极析出1.60g某金属,氧化性比氢离子强的金属离子均可能,则BD符合,
故答案为:280;1;BD.
(2)A与原电池的正极相连,A(石墨)电极的名称是阳极,故答案为:阳极;
(3)通入CH3OH的电极为负极,失去电子,则电极反应式为CH3OH+8OH-6e-═CO32-+6H2O,故答案为:CH3OH+8OH-6e-═CO32-+6H2O;
(4)乙为电解池,A与原电池的正极相连,则A为阳极,溶液中银离子、氢氧根离子放电,发生4AgNO3+2H2O
| ||
故答案为:4AgNO3+2H2O
| ||
(5)由电子守恒可知,O2~4Ag~4HNO3,n(O2)=
| 5.4g |
| 108g/mol |
| 1 |
| 4 |
n(HNO3)=0.05mol,则c(HNO3)=
| 0.05mol |
| 0.5L |
故答案为:280;1;BD.
点评:本题考查原电池和电解池,明确发生的电极反应、离子的放电顺序即可解答,注意电子守恒在计算中的应用,题目难度中等,注重了基础知识的考查.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
 (2008?枣庄一模)如图是一个化学反应过程的示意图.已知甲池的总反应式为:
(2008?枣庄一模)如图是一个化学反应过程的示意图.已知甲池的总反应式为: 如图是一个化学过程的示意图.
如图是一个化学过程的示意图.