题目内容
15.如图原电池的电池反应为Zn+Cu2+═Zn2++Cu,该原电池及电解质溶液可能是( )
| X | Y | 电解质溶液 | |
| A | Zn | Cu | ZnCl2溶液 |
| B | Cu | Zn | 稀H2SO4 |
| C | Cu | Zn | CuSO4溶液 |
| D | Zn | Zn | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据Zn+Cu2+═Zn2++Cu知,失电子化合价升高的Zn作负极,不如Zn活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐作电解质,据此分析解答.
解答 解:根据Zn+Cu2+═Zn2++Cu知,失电子化合价升高的Zn作负极,不如Zn活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐作电解质,AB电解质都不是可溶性铜盐,D中两个电极相同,所以符合条件的只有C选项,故选C.
点评 本题考查原电池设计,为高频考点,明确正负极材料及电解质判断方法是解本题关键,知道得失电子与电极的关系,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
5.下列元素非金属最强的是( )
| A. | S | B. | O | C. | Si | D. | P |
6.下列离子方程式正确的是( )
| A. | 将氯气通入氢氧化钡溶液中:Cl2+2 OH-=H2O+Cl-+ClO- | |
| B. | 贝壳溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++OH -+H++SO42-=BaSO4↓+H2O |
3.下列离子方程式正确的是( )
| A. | Fe与盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 氯气与H2O反应 Cl2+H2O═Cl-+2H++ClO- | |
| D. | 过量的CO2与Ca(ClO)2溶液反应:CO2+ClO-+H2O═HClO+HCO3- |
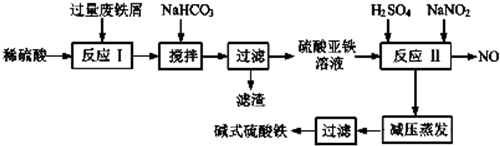
20.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如图:
已知部分阳离子以氧氧化物形式沉淀时溶液的pH如下表.
回答下列问题:
(1)加入过量废铁屑的目的是使铁离子充分被还原为亚铁离子,同时防止亚铁离子被空气中氧气氧化(用离子方程式表示);加入少量NaHCO3的目的是Al3++3HCO3-=Al(OH)3↓+3CO2↑;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,该流程中可以循环、回收利用的物质是NO;
(3)生产碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检测所得产品中是否含有Fe2+,应使用的试剂A.(填写字母)

已知部分阳离子以氧氧化物形式沉淀时溶液的pH如下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
(1)加入过量废铁屑的目的是使铁离子充分被还原为亚铁离子,同时防止亚铁离子被空气中氧气氧化(用离子方程式表示);加入少量NaHCO3的目的是Al3++3HCO3-=Al(OH)3↓+3CO2↑;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,该流程中可以循环、回收利用的物质是NO;
(3)生产碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检测所得产品中是否含有Fe2+,应使用的试剂A.(填写字母)
| A.酸性KMnO4溶液 B.KSCN溶液 | C.氯水 D.NaOH溶液. |
2.下列除杂方法可行的是AD
| 选项 | 物质(括号内为杂质) | 除杂试剂 |
| A | CO(CO2) | 通入过量澄清石灰水 |
| B | CaCl2溶液(HCl) | 加适量Ba(OH)2溶液 |
| C | HNO3溶液(H2SO4) | 加适量BaCl2溶液、过滤 |
| D | NaOH溶液(Na2CO3) | 加适量Ca(OH)2或Ba(OH)2溶液、过滤 |
 2C.
2C.