题目内容
14.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )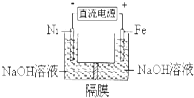
| A. | 铁是阳极,电极反应为Fe-6e-+4H2O═FeO42-+8H+ | |
| B. | 若隔膜为阴离子交换膜,则OH-自左向右移动 | |
| C. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| D. | 每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
分析 A、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子;
B、阴离子交换膜只允许阴离子通过;阴离子移向阳极;
C、电解过程中电子流向负极流向Ni电极,不能通过电解质溶液,是通过电解质溶液中离子定向移动实现闭合电路,通过Fe电极回到正极;
D.气体摩尔体积因温度压强不同而不同.
解答 解:A、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子,电极反应为Fe-6e-+8OH-═FeO42-+4H2O,故A错误;
B、阴离子交换膜只允许阴离子通过;阴离子移向阳极,应从左向右移动,故B正确;
C、电解过程中电子流向负极流向Ni电极,不能通过电解质溶液,是通过电解质溶液中离子定向移动实现闭合电路,通过Fe电极回到正极,故C错误;
D、温度和压强未知,所以无法计算生成气体体积,故D错误;
故选B.
点评 本题考查了电解原理,正确判断阴阳极及发生的反应是解本题关键,注意电子不能通过电解质溶液,易错选项是D,注意气体摩尔体积的适用范围和条件,题目难度适中.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
11.有机物X的分子式为C3H6O2,发生酸性水解后得到一元羧酸Y和一元醇Z,已知Y和Z的相对分子质量相等,则下列叙述错误的是( )
| A. | X的结构简式为HCOOCH2CH3 | B. | Y的分子中不含-CH3(甲基) | ||
| C. | Z不具有氧化性 | D. | Z分子中含有甲基且具有还原性 |
5.下列有机物的名称错误的是( )
| A. | 3,4,4-三甲基己烷 | B. | 3-乙基-1-丁烯 | ||
| C. | 1,2-二甲苯 | D. | 3-甲基-1-丁炔 |
9.目前海水提溴的最主要方法之一是空气吹出法工艺,其流程图如下:
含Br2的海水$\stackrel{①空气吹出}{→}$含Br2的空气$\stackrel{②SO_{2}吸收}{→}$吸收液$\stackrel{③氯化}{→}$溴水混合物$\stackrel{④蒸馏}{→}$液溴以下推断不合理的是( )
含Br2的海水$\stackrel{①空气吹出}{→}$含Br2的空气$\stackrel{②SO_{2}吸收}{→}$吸收液$\stackrel{③氯化}{→}$溴水混合物$\stackrel{④蒸馏}{→}$液溴以下推断不合理的是( )
| A. | 热空气能吹出溴是利用溴易挥发的性质 | |
| B. | SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr | |
| C. | 流程中循环利用的物质有SO2、Br2、Cl2等多种 | |
| D. | 没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
19.下列说法中正确的是( )
| A. | 熵增加且放热的反应一定能自发进行 | |
| B. | 若可逆反应正、逆反应速率改变,则化学平衡一定发生移动 | |
| C. | 放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 | |
| D. | 若某化学平衡发生移动,则平衡混合体系的压强一定发生改变 |
6.下列说法正确的是( )
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量的HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 自来水可以直接养金鱼 |
3.M元素的一个原子失去2哥电子,转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中正确的是( )
| A. | Z的电子式为 | B. | Z可表示为M2Y | C. | Z一定溶于水中 | D. | M形成+2价阳离子 |
4.下列实验操作、实验现象和解释或结论错误的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铁片放入浓硫酸中 | 无明显现象 | 铁片发生了钝化 |
| B | 将SO2通入Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性: H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加FeCl3溶液 | 有红褐色沉淀生成 | OH-+Fe3+=Fe(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |