题目内容
11.将镁、铜组成的合金1.28g投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物只有NO气体0.672L(标准状况),向反应后的溶液中加入足量的NaOH溶液.则形成沉淀的质量为2.81g.分析 硝酸被还原为NO气体且标准状况下体积为0.672L,即物质的量为0.03mol,根据氮元素的化合价变化计算转移电子物质的量.最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于金属的质量加氢氧根离子的质量.
解答 解:硝酸被还原为NO气体且标准状况下体积为0.672L,即物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,所以转移的电子的物质的量为:0.03mol×(5-2)=0.09mol,
最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,
所以最后沉淀质量为:1.28g+0.09mol×17g/mol=2.81g,
故答案为:2.81.
点评 本题考查混合物的计算,题目难度中等,解题关键是判断沉淀质量为金属与金属离子结合氢氧根离子的质量之和,可以根据氢氧化钠计算沉淀中氢氧根的物质的量更简单,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
1.NA为阿伏加德罗常数的值.下列说法错误的是( )
| A. | 18 g冰的晶体中含有氢键的数目为2 NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA | |
| D. | 1 mol C12与足量NaOH溶液反应,转移电子的数目为NA |
19.将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
| 操作 | 现象 | |
| A | 加入NaOH溶液 | 有红褐色沉淀 |
| B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| C | 加入酸性KMnO4溶液 | 紫色褪去 |
| D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有关醇的叙述正确的是( )
| A. | 所有醇都能发生催化氧化、消去反应 | |
| B. | 低级醇(甲醇、乙醇、丙醇、乙二醇)都能与水以任意比互溶 | |
| C. | 凡烃基直接和羟基相连的化合物一定是醇 | |
| D. | 乙醇和浓硫酸按1:3体积比混合、共热就一定产生乙烯. |
2.硫酸工业废渣回收再利用的工艺流程如下:
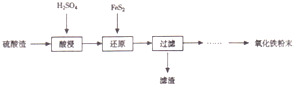
注:硫废渣(主要含Fe2O3、SiO2、Al2O3、MgO、等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②抑制Fe3+的水解
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+
(3 )为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量,实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2以二苯胺磺酸钠为指示剂,用K2Cr2O3标准溶液滴定,有关反应方程如下:
2Fe3++Sn2++6Cl-═2Fe2++SnCl42-
Sn2++4Cl-+2HgCl2═SnCl42-+Hg2Cl2↓
6Fe2++Cr2O32-+14H+═6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量偏低(填“偏高”、“偏低”、“不变”,下同)
②若不加HgCl2,则测定的Fe3+量偏高
(4)①可选用KSCN或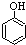 (填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
(填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
②已知部分阳离子以氢氧化物形成沉淀时溶液的pH见下表:
实验可选用的试剂有:稀HNO3,、Ba(NO3)2溶液、酸性KMn04溶液、NaOH溶液,要求制备过程中不产生有毒气体,请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
第一步:氧化向溶液中加入过量的酸性高锰酸钾溶液,搅拌(填写具体操作)
笫二步:沉淀滴加NaOH溶液,调节溶液为pH为3.2~3.8(填写具体操作)
第三步:分离,洗涤;
第四步:烘干.研磨.

注:硫废渣(主要含Fe2O3、SiO2、Al2O3、MgO、等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②抑制Fe3+的水解
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+
(3 )为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量,实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2以二苯胺磺酸钠为指示剂,用K2Cr2O3标准溶液滴定,有关反应方程如下:
2Fe3++Sn2++6Cl-═2Fe2++SnCl42-
Sn2++4Cl-+2HgCl2═SnCl42-+Hg2Cl2↓
6Fe2++Cr2O32-+14H+═6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量偏低(填“偏高”、“偏低”、“不变”,下同)
②若不加HgCl2,则测定的Fe3+量偏高
(4)①可选用KSCN或
 (填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
(填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O②已知部分阳离子以氢氧化物形成沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | A1(0H)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
第一步:氧化向溶液中加入过量的酸性高锰酸钾溶液,搅拌(填写具体操作)
笫二步:沉淀滴加NaOH溶液,调节溶液为pH为3.2~3.8(填写具体操作)
第三步:分离,洗涤;
第四步:烘干.研磨.
3.下列气体中不属于大气污染物的是( )
| A. | O3 | B. | SO2 | C. | CO | D. | N2 |