题目内容
 在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H①下列情形不能说明该反应已达到平衡状态的是
A.每消耗1mol CO的同时生成2mol H2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
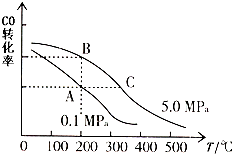
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)
③某温度下,将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率=
考点:化学平衡状态的判断,等效平衡,化学平衡的计算
专题:化学平衡专题
分析:①达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
②化学反应的平衡常数随着温度的变化而变化,根据压强恒定,温度变化引起化学平衡移动的方向来判断化学反应的吸放热情况;
③根据化学反应三行式来计算转化率和平衡常数.
②化学反应的平衡常数随着温度的变化而变化,根据压强恒定,温度变化引起化学平衡移动的方向来判断化学反应的吸放热情况;
③根据化学反应三行式来计算转化率和平衡常数.
解答:
解:A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故c正确
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C.
②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,根据图示内容,压强不变,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以该反应是一个放热反应,故答案为:=;<;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率
×100%=75%,此温度下的化学平衡常数K=
=
≈1.3,故答案为:1.3.
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故c正确
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C.
②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,根据图示内容,压强不变,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以该反应是一个放热反应,故答案为:=;<;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率
| 0.75 |
| 1 |
| c(CH3OH) |
| c(CO)?c(H2)3 |
| 0.75 |
| 0.25×1.52 |
点评:化学平衡状态的判断、化学反应速率以及化学平衡常数、转化率是现在考试的热点,注意三行式在计算中的应用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式中,书写正确的是( )
| A、氢氧化钡和硫酸的反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、稀盐酸与石灰石反应:CO32-+2H+=CO2↑+H2O |
| C、用氨水吸收过量的二氧化硫:NH3?H2O+SO2=NH4++HSO3- |
| D、氯化亚铁溶液中加入足量的硝酸:2Fe2++4H++NO3-=2Fe3++2H2O+NO↑ |
2010年我国“两会…‘一号提案”锁定“低碳经济”,下列做法不符合“低碳经济”的是( )
①禁止电动自行车上路;
②以煤等燃料作为主要生活燃料;
③鼓励私人购买和使用小汽车以代替公交车;
④利用太阳能、风能和氢能等新能源代替化石燃料.
①禁止电动自行车上路;
②以煤等燃料作为主要生活燃料;
③鼓励私人购买和使用小汽车以代替公交车;
④利用太阳能、风能和氢能等新能源代替化石燃料.
| A、①②③ | B、②④ |
| C、①④ | D、②③④ |
下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温下,0.05mol?L-1Fe2(SO4)3溶液中含Fe3+数目为0.1NA |
| B、标准状况下,22.4L甲苯中含C-H数目为8 NA |
| C、常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA |
| D、0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2NA |