题目内容
【题目】根据图1、图2、图3及题中信息,回答下列问题
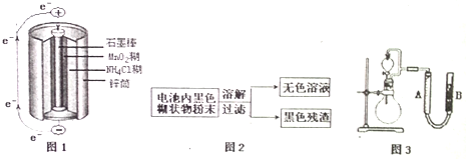
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 |
|
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
【答案】Zn ![]()
![]() 烧杯和玻璃棒 催化剂 氧化剂 上下移动B管,使A、B两管中液面相平 2:1
烧杯和玻璃棒 催化剂 氧化剂 上下移动B管,使A、B两管中液面相平 2:1
【解析】
![]() 锌锰干电池的负极上Zn失去电子;
锌锰干电池的负极上Zn失去电子; ![]() 离子在正极得电子生成氨气和氢气;根据
离子在正极得电子生成氨气和氢气;根据![]() 计算消耗Zn的质量;
计算消耗Zn的质量;
(2)根据基本操作溶解和过滤操作分析;
(3)实验一涉及反应为![]() ,实验二中的反应为
,实验二中的反应为![]() 。
。
![]() 锌锰干电池的负极上Zn失去电子,负极反应为
锌锰干电池的负极上Zn失去电子,负极反应为![]() ,该电池的负极材料是Zn;由
,该电池的负极材料是Zn;由![]() 离子在正极放电产生2种气体,其中一种气体分子是含
离子在正极放电产生2种气体,其中一种气体分子是含![]() 的微粒为氨气,另一种为氢气,正极反应为
的微粒为氨气,另一种为氢气,正极反应为![]() ,当电路中每通过
,当电路中每通过![]() ,根据负极反应
,根据负极反应![]() ,可知消耗
,可知消耗![]() ,质量为
,质量为![]() ;
;
![]() 溶解需要玻璃棒、烧杯等仪器,过滤需要玻璃棒、烧杯以及漏斗等仪器,则均使用的玻璃仪器为烧杯和玻璃棒;
溶解需要玻璃棒、烧杯等仪器,过滤需要玻璃棒、烧杯以及漏斗等仪器,则均使用的玻璃仪器为烧杯和玻璃棒;
![]() ①充分反应后未见黑色固体物质减少,二氧化锰起到催化剂的作用,过氧化氢在二氧化锰催化作用下生成氧气;
①充分反应后未见黑色固体物质减少,二氧化锰起到催化剂的作用,过氧化氢在二氧化锰催化作用下生成氧气;
②充分反应后黑色粉末部分溶解,生成锰离子,Mn元素化合价降低,反应中二氧化锰起到氧化剂的作用;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意上下移动B管,使A、B两管中液面相平;
④实验一涉及反应为![]() 、实验二中反应生成锰离子、水、氧气,离子反应为
、实验二中反应生成锰离子、水、氧气,离子反应为![]() ,由氧气的体积1:1可知,参加反应的
,由氧气的体积1:1可知,参加反应的![]() 的物质的量之比为2:1。
的物质的量之比为2:1。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】已知在温度低于570 ℃时,还原铁粉与水蒸气反应的产物是FeO,高于570 ℃时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
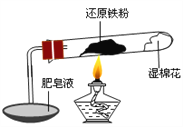
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是
A.试管内的固体一定含有铁粉
B.试管内的固体一定不含有Fe3O4
C.不能确定试管内的固体一定含有FeO
D.可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
【题目】温度为T时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]()
![]() ,反应
,反应![]() 经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是
经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是![]()
| 0 | 50 | 150 | 250 | 350 |
| 0 |
|
|
|
|
A.反应在前50s的平均速率![]()
![]()
B.保持其他条件不变,升高温度,平衡时![]()
![]() ,则反应的
,则反应的![]()
C.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()