题目内容
10.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定不含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下2.24L混合气体、3.36L二氧化碳的物质的量,再根据n=$\frac{m}{M}$计算出水的物质的量,从而可确定混合物的平均分子式,根据计算结果对各选项进行判断.
解答 解:标况下2.24L混合气体的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
标况下3.36L二氧化碳的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,0.15mol二氧化碳中含有0.15molC,
2.7g水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,0.15mol水中含有0.3molH,
则该混合烃中含有的平均C、H原子数为:N(C)=$\frac{0.15mol}{0.1mol}$=1.5、N(H)=$\frac{0.3mol}{0.1mol}$=3,
该混合烃的平均分子式为:C1.5H3,
碳原子数小于1.5的烃只有甲烷,则一定含有CH4,
甲烷分子中H原子数为4>3,则另一种烃分子中H原子数<3,且C原子数>1.5,满足该条件的烃只有乙炔,
故该气体为甲烷和乙炔的混合烃,只有B正确,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握质量守恒定律、平均值法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.同周期的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性HX>H2Y>ZH3 | ||
| C. | 电负性:X>Y>Z | D. | 非金属性:X>Y>Z |
15.下列的氢氧化物中,碱性最强的是( )
| A. | Mg(OH)2 | B. | NaOH | C. | Al(OH)3 | D. | Si(OH)4 |
19.下列说法正确的是( )
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
20.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜1万倍;N5可以做烈性炸药.下列叙述正确的是( )
| A. | 14C的质子数为14 | B. | N5N2互为同素异形体 | ||
| C. | 金刚石和纳米管互为同位素 | D. | C原子半径比N原子半径小 |

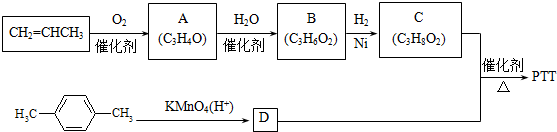
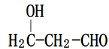 .
.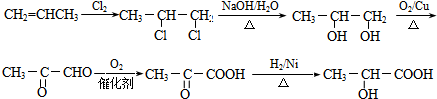 .
.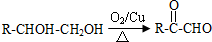

 ; F
; F  ;
;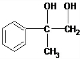 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;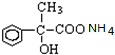 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.