题目内容
现有 和
和 混合溶液,其中
混合溶液,其中 和
和 的物质的量之和为0.1mol,在此溶液中入
的物质的量之和为0.1mol,在此溶液中入 的NaOH溶液,使其充分反应.设
的NaOH溶液,使其充分反应.设 物质的量与总物质的量的比值x.
物质的量与总物质的量的比值x.
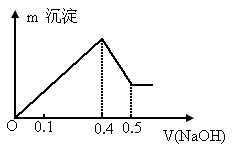
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质量有多少?

(2)计算沉淀中只有 时x的取值范围.请在上图中画出淀总量
时x的取值范围.请在上图中画出淀总量 随
随 变化的曲线
变化的曲线
(3)若 和
和 的物质的量之和为
的物质的量之和为 (a为合理数值).其他条件不变时,求沉淀中同时有
(a为合理数值).其他条件不变时,求沉淀中同时有 、
、 的x的取值范围和各沉淀的物质的量(用含有a、x的式子表示).
的x的取值范围和各沉淀的物质的量(用含有a、x的式子表示).
答案:略
解析:
解析:
|
根据所示 (1)  
=0.04mol, 
由反应 
0.06mol →0.18mol→0.06mol
余 
所以有  沉淀. 沉淀.
(2) 要使沉淀中无 ,至少需 ,至少需 x为最大取值时,有 x为最大取值时,有
x=0.6 ,所以在0≤x≤0.6时,沉淀只有 . .
x=0 , 沉淀为0.1mol; 沉淀为0.1mol;
x=0.4 , 沉淀为0.06mol; 沉淀为0.06mol;
x=0.6 , 沉淀为0.04mol; 沉淀为0.04mol;
在 0.6≤x≤1内沉淀总量n=0.1mol-(0.09×4-0.1×3)mol=0.04mol;
(3) 
 , ,
|

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
已知:Br2+2Fe2+═2Br-+2Fe3+、2Fe3++2I-═2Fe2++I2;现有一混合溶液,只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为( )
| A、7:1 | B、7:3 | C、7:2 | D、7:4 |
现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.30mol?L-1,c(Cl-)=1.20mol?L-1,要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要1.00mol?L-1的NaOH溶液的体积为( )
| A、80 mL | B、100 mL | C、120 mL | D、140 mL |
现有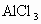 和
和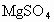 混合溶液,向其中不断加入NaOH溶液,得到的沉淀的量与加入NaOH溶液的体积如图所示,则原溶液中
混合溶液,向其中不断加入NaOH溶液,得到的沉淀的量与加入NaOH溶液的体积如图所示,则原溶液中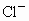 、
、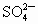 的物质的量之比为
的物质的量之比为
[ ]
|
A.1∶1 |
B.2∶3 |
C.3∶2 |
B.6∶1 |







 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.