题目内容
20.NH3和NO2在催化剂作用下反应:8NH3+6NO2═7N2+12H2O.若还原产物比氧化产物少0.1mol,则下列判断正确的是( )| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
分析 8NH3+6NO2═7N2+12H2O中,氨气为还原剂,二氧化氮为氧化剂,则由N原子守恒可知7molN2中,3mol为还原产物,4mol为氧化产物,即该反应中还原产物比氧化产物少1mol,同时转移电子为24e-,以此来解答.
解答 解:8NH3+6NO2═7N2+12H2O中,氨气为还原剂,二氧化氮为氧化剂,则由N原子守恒可知7molN2中,3mol为还原产物,4mol为氧化产物,即该反应中还原产物比氧化产物少1mol,同时转移电子为24e-,
A.若还原产物比氧化产物少0.1mol,转移电子为2.4mol,转移电子2.4NA个,故A错误;
B.若还原产物比氧化产物少0.1mol,生成单质为0.7mol,标况下体积为0.7mol×22.4L/mol=15.68L,故B错误;
C.若还原产物比氧化产物少0.1mol,还原剂为0.8mol,氧化剂为0.6mol,还原剂比氧化剂多0.2mol,故C正确;
D.氧化剂被还原,由选项C可知,被还原的氮原子是0.6mol×14g/mol=8.4g,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、基本概念及转移电子为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列叙述中,正确的是( )
| A. | 氧化还原反应的本质是元素化合价发生了变化 | |
| B. | 含化合价升高元素的反应物被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,氧化剂和还原剂一定是两种物质 |
12.要使在容积恒定的密闭容器中进行的可逆反应2A(气)+B(固)═2C(气),△H<0的正反应速率显著加快,可采用的措施是(不考虑固、气态间的接触面积)( )
| A. | 降温 | B. | 加入B | ||
| C. | 增大体积使压强减小 | D. | 加入A |
9.用于电动汽车的铝-空气燃料电池通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.则下列说法正确的是( )
| A. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| B. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
10.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+ Na+CO32- Cl- | B. | K+、Al3+、Cl-、OH- | ||
| C. | Fe3+、Al3+、SCN-、Cl- | D. | Ag+ Al3+ NO3-H+ |

 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1,.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1,.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.

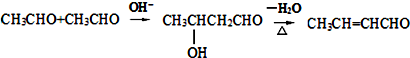
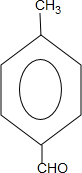 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O.
 .
.