题目内容
16.用下列实验装置进行相应的实验,不能达到实验目的是( )| A | B | C | D | |
| 装置 | 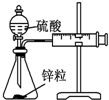 | 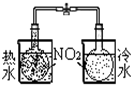 | 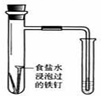 | 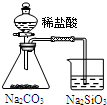 |
| 实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.秒表测定时间,针筒测定气体的体积;
B.温度对反应平衡的影响导致气体颜色的变化;
C.食盐水为中性,则正极氧气得到电子;
D.盐酸为挥发性酸,不能利用盐酸与最高价含氧酸的酸性比较非金属性.
解答 解:A.秒表测定时间,针筒测定气体的体积,由v=$\frac{△V}{△t}$可比较锌与不同浓度的稀硫酸反应的快慢,故A正确;
B.二氧化氮为红棕色气体,温度对反应平衡的影响导致气体颜色的变化,则能证明温度对化学平衡的影响,故B正确;
C.食盐水为中性,则正极氧气得到电子,负极上Fe失去电子,可验证铁钉发生吸氧腐蚀,故C正确;
D.盐酸为挥发性酸,不能利用盐酸与最高价含氧酸的酸性比较非金属性,则不能比较Cl、C、Si的非金属性,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率的测定、温度对化学平衡的影响、电化学腐蚀及非金属性比较等,把握实验技能及化学反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
6.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 选项 | 化学反应 | 离子方程式 | 评价 |
| A | NaClO溶液中通入过量SO2气体 | ClO-+H2O+SO2═HClO+HSO3- | 正确 |
| B | NH4HSO3溶液中加入等量NaOH | HSO3-+OH-═SO32-+H2O | 错误,OH-能同时与NH4+、HSO3-反应 |
| C | Na2CO3 的水解 | CO32-+H2O?CO2↑+2OH- | 错误,水解反应不加气体符号 |
| D | 用稀硝酸清洗做过银镜反应的试管 | Ag+4H++NO3-═Ag++NO↑+2H2O | 错误,等式两端电荷不守恒 |
| A. | A | B. | B | C. | C | D. | D |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L 1 mol•L-1AlCl3溶液中含有的Al3+数目为NA | |
| C. | 在标况下,11.2L氯气通入足量的NaOH溶液中转移电子数为NA | |
| D. | 18g重水(D2O)含有的中子数为10 NA |
11.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| B. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
1.下列离子方程式正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- |
8.在含有K+、I-、NO3-、AlO2-、SO32-,且阴离子浓度均为0.1mol/L的溶液中加入等体积浓度为1mol/L的NaHSO4溶液丙充分反应.下列对所得溶液的有关说法正确的是( )
| A. | 浓度最大的离子是Na+ | B. | 溶液显酸性 | ||
| C. | c(K+)=0.05mol/L | D. | 阴离子种类多于阳离子 |
5.某种锂电池用金属和石墨作电极材料,电解质量溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(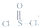 )中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )
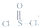 )中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )| A. | 电解质溶液中混入水,对电池反应无影响 | |
| B. | 金属锂被还原,作电池的负极 | |
| C. | 电池工作过程中,Cl-向石墨电极移动 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 |
12.下列分子内各原子均在同一平面上的是①甲烷②乙烯③乙炔④苯( )
| A. | 全部 | B. | 只有① | C. | ②和③ | D. | ②③④ |



