题目内容
13.某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图象如图所示: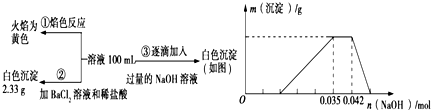
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定存在的离子有Na+、Al3+、NH4+、H+、SO42-,一定不存在的离子有:Fe3+、Mg2+、CO32-.
(2)第②组实验中白色沉淀为BaSO4(填化学式).
(3)写出实验③图象中沉淀溶解阶段发生的离子反应方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为1:1.
分析 无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、NH4+、H+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(H+),再根据电荷守恒确定有没有NO3-.
解答 解:(1)无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Na+、Al3+、NH4+、H+、SO42-,废水中一定不存在的离子有Fe3+、Mg2+、CO32-,
故答案为:Na+、Al3+、NH4+、H+、SO42-;Fe3+、Mg2+、CO32-;
(2)Ba2+能与SO42-产生沉淀,第②组实验中2.33g沉淀为硫酸钡,
故答案为:BaSO4;
(3)氢氧化铝能溶于氢氧化钠中,即Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)已知硫酸钡沉淀为2.33g,则n(SO42-)=$\frac{2.33g}{233g/mol}$=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.007mol,
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
所以n(Al3+)=0.007mol,将铝离子沉淀需要氢氧化钠0.021mol,所以溶液中H+消耗氢氧化钠0.014mol,氢离子的物质的量是0.014mol,
NH4++OH-=NH3•H2O,消耗氢氧化钠0.007mol,所以铵根离子的物质的量是0.007mol,原溶液中c(NH4+)与c(Al3+)的比值为1:1,
故答案为:1:1.
点评 本题考查了常见离子检验,现象的判断和离子检验,关键是图象分析离子特征和离子共存的判断,题目难度中等.

 寒假学与练系列答案
寒假学与练系列答案| A. | 1mol KClO3 | B. | 0.5mol H3PO4 | C. | 1mol O2 | D. | 3.01×1023个CO2 |
| A. | 容量瓶和量筒上均标有温度,且量筒和容量瓶均无“0”刻度 | |
| B. | 用丁达尔现象可鉴别蛋白质溶液、葡萄糖溶液和淀粉溶液 | |
| C. | 用洁净玻璃棒蘸取少量溶液,放在酒精灯上灼烧,透过蓝色钴玻璃观察K的焰色 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| A. | 燃烧反应一定是放热反应 | |
| B. | 反应物总能量大于生成物总能量 | |
| C. | 反应物键能总和大于生成物键能总和 | |
| D. | 是体系将储存的能量释放出来的过程 |
| A. | 铜、铁和FeCl3溶液形成的原电池,铜极放出氢气 | |
| B. | 电解硫酸钠溶液就是电解水,电解后溶液pH升高 | |
| C. | 铁锅生锈的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应为:2H++2e-═H2↑ |
| A. | $\frac{a}{22.4}$mol/L | B. | $\frac{ab}{22400}$mol/L | ||
| C. | $\frac{22400}{ab}$mol/L | D. | $\frac{1000ab}{22400+36.5a}$mol/L |
| A. | 镁是一种银白色固体 | |
| B. | 镁是热和电的良导体 | |
| C. | 镁在自然界中主要以单质的形式存在 | |
| D. | 镁常温下能与氧气反应,生成一层致密的氧化薄膜 |