题目内容
11.下列说法正确的是( )| A. | 金属元素与非金属元素形成的化学键一定是离子键 | |
| B. | ⅠA族和ⅦA族原子化合时,一定生成离子键 | |
| C. | 仅非金属元素形成的化合物中一定不是离子键 | |
| D. | 活泼金属与活泼非金属化合时,能形成离子键 |
分析 A.金属元素和非金属元素之间可能形成共价键;
B.第IA族和第VIIA族元素之间可能形成共价键;
C.仅含有非金属元素的化合物中可能含有离子键;
D.活泼金属和活泼非金属元素之间易形成离子键.
解答 解:A.金属元素和非金属元素之间可能形成共价键,如氯化铝,故A错误;
B.第IA族和第VIIA族元素之间可能形成共价键,如HX,故B错误;
C.仅含有非金属元素的化合物中可能含有离子键,如铵盐,故C错误;
D.活泼金属和活泼非金属元素之间易形成离子键,原子之间通过得失电子形成离子键,故D正确;
故选D.
点评 本题考查离子键判断,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,易错选项是C,注意规律中的反常现象,如BC.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列关于多电子原子核外电子的运动规律的叙述正确的是( )
| A. | 原子核外各电子层上的电子数均已达到2n2 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域绕核运动 |
19.下列分子种的碳原子不可能同在一个平面的是( )
| A. |  | B. |  | C. | CH3-C≡C-CH3 | D. |  |
16.某短周期元素M,其原子的最外层电子数和次外层电子数的差的绝对值与最外层达到饱和所需电子数相等,下列有关叙述正确的是( )
| A. | M元素一定是第VA族元素 | |
| B. | M元素一定是第三周期元素 | |
| C. | M可形成与CH3CHO电子数相等的化合物 | |
| D. | M的单质在空气中加热时可能会生成红棕色气体 |
20.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$mol/(L•min) | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 三个容器中反应的平衡常数均为K=2 |
1.如表是元素周期表的一部分,短周期元素X的最高化合价是+5,Y的单质可在空气中燃烧.
请回答下列问题:
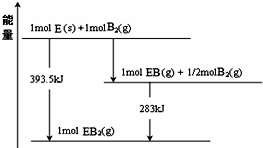
(1)Y在元素周期表的位置是第三周期第ⅥA族,其氢化物的电子式为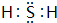 .
.
(2)B元素与Y、Z同主族,且原子半径比二者小.E是形成化合物种类最多的元素,已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图所示,请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5 kJ•mol -1.
(3)25℃时,NaH2XO2溶液pH>7,向100mL 0.01mol•L-1的H3XO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积<(填“>”、“=”或“<”)100mL.
(4)W的最高价氧化物能溶于烧碱溶液,该反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.现取100mL 1mol•L-1W的氯化物溶液,向其中加入1mol•L-1NaOH溶液产生了3.9g的沉淀,则加入的氢氧化钠溶液体积可能是150或350 mL.
(5)探究同主族元素性质的相似性,是学习化学的重要方法之一.在下表中列出对H2ZO3各种不同化学性质的推测,请根据示例填写下列空格(Z元素符号仍用Z表示)
| W | X | Y | |
| Z |
(1)Y在元素周期表的位置是第三周期第ⅥA族,其氢化物的电子式为
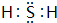 .
.(2)B元素与Y、Z同主族,且原子半径比二者小.E是形成化合物种类最多的元素,已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图所示,请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5 kJ•mol -1.

(3)25℃时,NaH2XO2溶液pH>7,向100mL 0.01mol•L-1的H3XO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积<(填“>”、“=”或“<”)100mL.
(4)W的最高价氧化物能溶于烧碱溶液,该反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.现取100mL 1mol•L-1W的氯化物溶液,向其中加入1mol•L-1NaOH溶液产生了3.9g的沉淀,则加入的氢氧化钠溶液体积可能是150或350 mL.
(5)探究同主族元素性质的相似性,是学习化学的重要方法之一.在下表中列出对H2ZO3各种不同化学性质的推测,请根据示例填写下列空格(Z元素符号仍用Z表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+3H2O |
| ① | 还原性 | |
| ② | H2ZO3+2NaOH═Na2ZO3+2H2O |
 碳元素能够形成不同的单质,如C60、C70、金刚石等等.
碳元素能够形成不同的单质,如C60、C70、金刚石等等. 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( )