题目内容
如图为相互串联的甲、乙两电解池。试回答:
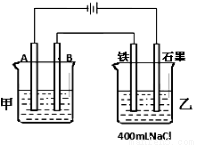
(1)若甲电解池利用电解原理在铁上镀铜,则A是 、 (填电极材料和电极名称),电极反应是 ;B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
(1)(各1分)铁; 阴极; Cu2++2e-=Cu;铜;阳极;Cu2+—2e-=Cu2+ 含Cu2+的溶液(或可溶性铜盐皆可);红;
(2)(各2分)0.1; 13
(3)(2分,等式或算式和结果各1分)根据电量守恒,电路中通过的物理电量等于电解时发生氧化还原反应中两极上转移的电子的化学电量。所以有:
Q=It=2×NA×1.60×10—19 C×0.25g/64g·mol—1
It=0.21A×60×60s
NA =6.05×1023mol—1
【解析】
试题分析:⑴电镀利用的是电解的原理,电镀池中,阳极是镀层金属,阴极是镀件,电解质是含有镀层金属离子的盐溶液。
⑵若电解池甲中阴极增重1.28g,则表明有0.02mol的铜溶解。在电路中转移0.04mol的电子,同样在乙池中也转移0.04mol的电子,那么此时生成的氢氧化钠为0.04mol,因此其浓度为:0.1mol/L。那么溶液中的氢离子浓度就为 ,所以其pH=13。
,所以其pH=13。
⑶根据电量守恒,电路中通过的物理电量等于电解时发生氧化还原反应中两极上转移的电子的化学电量。所以有:
Q=It=2×NA×1.60×10—19 C×0.25g/64g·mol—1
It=0.21A×60×60s
NA =6.05×1023mol—1
考点:考查电解的有关知识。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案



